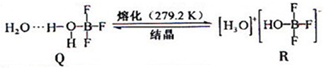
题目内容
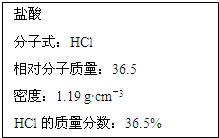 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol?L-1的稀盐酸.
可供选用的仪器有:①胶头滴管; ②玻璃棒; ③烧杯; ④药匙; ⑤量筒; ⑥托盘天平.
请回答下列问题:
①配制稀盐酸时,还缺少的仪器有
A 温度 B 浓度 C 容量 D 压强 E刻度线
②该学生需要量取
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”).
a.用量筒量取浓盐酸时俯视观察凹液面.
b.量筒量取浓盐酸后有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
(4)假设该同学成功配制了0.400mol?L-1的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据c=
计算;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)①利用浓盐酸稀释配制500mL稀盐酸溶液,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;容量瓶上标有温度、容量、刻度线;
②根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;
③分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对所配溶液浓度的影响.
(4)根据n(HCl)=n(NaOH)计算.
| 1000ρω |
| M |
(2)溶液是均匀的,溶液的密度、浓度不随体积变化;
(3)①利用浓盐酸稀释配制500mL稀盐酸溶液,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;容量瓶上标有温度、容量、刻度线;
②根据稀释定律,稀释前后HCl的物质的量不变,据此计算需要浓盐酸的体积;
③分析操作对溶质物质的量、溶液体积的影响,根据c=
| n |
| V |
(4)根据n(HCl)=n(NaOH)计算.
解答:
解:(1)质量分数36.5%、密度1.19g/mL 浓盐酸的物质的量浓度=
=11.9mol/L,
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)①利用浓盐酸稀释配制500mL稀盐酸溶液,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故还需要的仪器有:500mL容量瓶,
容量瓶上标有温度、容量、刻度线,故答案为:500mL容量瓶;ACE;
②令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:
V×10-3L×11.9mol/L=0.5 L×0.400mol/L
解得:V=16.8
故答案为:16.8;
③a、用量筒量取浓盐酸时俯视观察凹液面,读数偏小,故选B;
b、量筒量取浓盐酸后用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,会导致配制的溶液中溶质的量偏大,浓度变大,故选A;
(4)①n(HCl)=n(NaOH)=0.01mol,V(HCl)=
=0.025L=25mL,故答案为:25.
| 1000×1.19×36.5% |
| 36.5 |
故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关,
故答案为:BD;
(3)①利用浓盐酸稀释配制500mL稀盐酸溶液,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故还需要的仪器有:500mL容量瓶,
容量瓶上标有温度、容量、刻度线,故答案为:500mL容量瓶;ACE;
②令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:
V×10-3L×11.9mol/L=0.5 L×0.400mol/L
解得:V=16.8
故答案为:16.8;
③a、用量筒量取浓盐酸时俯视观察凹液面,读数偏小,故选B;
b、量筒量取浓盐酸后用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,会导致配制的溶液中溶质的量偏大,浓度变大,故选A;
(4)①n(HCl)=n(NaOH)=0.01mol,V(HCl)=
| 0.01mol |
| 0.400mol/L |
点评:本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,难度不大,注意根据c=
理解溶液配制原理及进行误差分析.
| n |
| V |

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
 在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)?nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所.下列结论正确的是( )
在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)?nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所.下列结论正确的是( )| A、p1>p2 n<3 |
| B、p1<p2 n>3 |
| C、p1<p2 n=3 |
| D、p1>p2 n>3 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4 L三氧化硫含有的分子数为NA |
| B、39克过氧化钠与足量的二氧化碳反应转移的电子数为NA |
| C、1mol甲基含有的电子数为7 NA |
| D、常温常压下,28克乙烯和环丙烷的混合气体中含有的碳原子数为2 NA |
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )


| A、试剂1可以选用石灰乳 |
| B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 |
| C、工业上,电解熔融MgO冶炼金属镁可减小能耗 |
| D、可用BaCl2溶液除去粗盐中的SO42- |
下列叙述正确的是( )
| A、将40g NaOH溶解于1L水中,得到1mol?L-1的NaOH溶液 |
| B、将11.2L HCl气体通入水中配成0.5L溶液,浓度为1mol?L-1 |
| C、将1L 10 mol?L-1的盐酸与9L水混合,混合液浓度为1mol?L-1 |
| D、10g NaOH溶解在水中配成250mL溶液,其浓度为1mol?L-1 |