题目内容
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )


| A、试剂1可以选用石灰乳 |
| B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 |
| C、工业上,电解熔融MgO冶炼金属镁可减小能耗 |
| D、可用BaCl2溶液除去粗盐中的SO42- |
考点:海水资源及其综合利用
专题:化学应用
分析:A.石灰乳和镁离子反应生成氢氧化镁沉淀;
B.氯气具有强氧化性,能将溴离子氧化为溴单质;
C.工业上电解熔融氯化镁冶炼镁;
D.硫酸钡不溶于水和酸;
B.氯气具有强氧化性,能将溴离子氧化为溴单质;
C.工业上电解熔融氯化镁冶炼镁;
D.硫酸钡不溶于水和酸;
解答:
解:A.煅烧贝壳得到CaO,将CaO溶于水得到石灰乳,石灰乳和镁离子反应生成氢氧化镁沉淀,试剂1廉价且原料来源广泛,故A正确;
B.氯气能将溴离子氧化为溴单质,从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2,然后采用萃取的方法从溶液中获取溴,故B正确;
C.氧化镁熔点很高,氯化镁熔点较氧化镁低,电解氧化镁冶炼镁增加成本,所以工业上采用电解熔融氯化镁的方法冶炼镁,故C错误;
D.氯化钡和硫酸根离子反应生成难溶性的硫酸钡,且氯离子不是杂质离子,故D正确;
故选C.
B.氯气能将溴离子氧化为溴单质,从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2,然后采用萃取的方法从溶液中获取溴,故B正确;
C.氧化镁熔点很高,氯化镁熔点较氧化镁低,电解氧化镁冶炼镁增加成本,所以工业上采用电解熔融氯化镁的方法冶炼镁,故C错误;
D.氯化钡和硫酸根离子反应生成难溶性的硫酸钡,且氯离子不是杂质离子,故D正确;
故选C.
点评:本题考查了海水资源的开发和利用,涉及氧化还原反应、除杂、金属的冶炼等知识点,明确物质的性质是解本题关键,知道根据金属活动性强弱选取合适的冶炼方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA表示阿伏加德罗常数,数值约为6.02×1023.下列说法正确的是( )
| A、2.4 g金属镁变成镁离子时失去的电子数目为6.02×1022 |
| B、2 g氢气所含分子数目为2×6.02×1023 |
| C、在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 |
| D、标准状况下,以任意比混合的氢气和氧气混合物2.24 L,所含的分子数为6.02×1022 |
下列各组离子,在强碱性溶液中可以大量共存的是( )
| A、Cu2+、Ba2+、Cl-、SO42- |
| B、Na+、Ba2+、Cl-、NO3- |
| C、Mg2+、K+、Cl-、NO3- |
| D、Na+、K+、NO3-、H+ |
乙酸的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L乙酸溶液的pH约为3 |
| B、乙酸能与水以任何比例互溶 |
| C、10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 |
| D、同温同浓度的乙酸溶液的导电性比硫酸溶液的弱 |
在催化剂高温的条件下,C3H8能够发生催化裂化,反应方程式如下:C3H8→C2H4+CH4,根据下表键能数据,下列说法正确的是( )
| 共价键类型 | C-C | C=C | C-H |
| 键能kJ/mol | 332 | 611 | 414 |
| A、C3H8、C2H4、CH4互为同系物 |
| B、C-C比C=C更活泼 |
| C、若1 mol C3H8完全反应,能够吸收53 kJ的热量 |
| D、可用酸性高锰酸钾除去混合气体中的C2H4,得到纯净的CH4 |
下列表述不正确的是( )
| A、常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 |
| B、NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中阴离子只有CO32-和OH- |
| D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
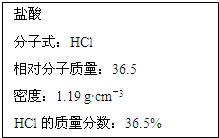 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: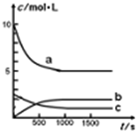 一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示:
一定温度下,在体积为1L的恒容密闭容器中充入10mol NO2和2.5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g)△H<0.反应混合物中NO2和物质的量浓度随时间的变化如表所示: