题目内容
下列叙述正确的是( )
| A、将40g NaOH溶解于1L水中,得到1mol?L-1的NaOH溶液 |
| B、将11.2L HCl气体通入水中配成0.5L溶液,浓度为1mol?L-1 |
| C、将1L 10 mol?L-1的盐酸与9L水混合,混合液浓度为1mol?L-1 |
| D、10g NaOH溶解在水中配成250mL溶液,其浓度为1mol?L-1 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、计算溶质氢氧化钠为1mol,溶于1L水,溶液体积不是1L;
B、气体 压强不知不能计算溶质物质的量;
C、1L溶液和9L溶液混合后溶液体积体积不是10L;
D、依据n=
计算溶质物质的量,结合c=
计算得到.
B、气体 压强不知不能计算溶质物质的量;
C、1L溶液和9L溶液混合后溶液体积体积不是10L;
D、依据n=
| m |
| M |
| n |
| V |
解答:
解:A、计算溶质氢氧化钠为1mol,溶于1L水,溶液体积不是1L,将40g NaOH溶解于1L水中,得到NaOH溶液浓度小于1mol?L-1,故A错误;
B、气体压强不知不能计算溶质物质的量,11.2L HCl气体物质的量不是0.5mol,故B错误;
C、1L溶液和9L溶液混合后溶液体积体积不是10L,混合液浓度大于1mol?L-1,故C错误;
D、依据n=
计算溶质物质的量=
=0.25mol,计算得浓度到c=
=
=1mol/L,故D正确;
故选D.
B、气体压强不知不能计算溶质物质的量,11.2L HCl气体物质的量不是0.5mol,故B错误;
C、1L溶液和9L溶液混合后溶液体积体积不是10L,混合液浓度大于1mol?L-1,故C错误;
D、依据n=
| m |
| M |
| 10g |
| 40g/mol |
| n |
| V |
| 0.25mol |
| 0.25L |
故选D.
点评:本题考查了物质的量浓度概念分析和计算应用,注意溶液体积的变化,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列化学用语书写正确的是( )
| A、碳酸氢钙CaHCO3 |
B、氯离子的结构示意图为: |
| C、氦气 He2 |
| D、硫酸的电离方程式:H2SO4=H2++SO42- |
下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液中;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去溴苯中少量的溴:加入足量氢氧化钠溶液洗涤,分液、干燥、蒸馏;
④除去乙醇中少量的水:加足量生石灰,蒸馏制无水乙醇.
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液中;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去溴苯中少量的溴:加入足量氢氧化钠溶液洗涤,分液、干燥、蒸馏;
④除去乙醇中少量的水:加足量生石灰,蒸馏制无水乙醇.
| A、全部正确 | B、②④ |
| C、②③④ | D、②③ |
在催化剂高温的条件下,C3H8能够发生催化裂化,反应方程式如下:C3H8→C2H4+CH4,根据下表键能数据,下列说法正确的是( )
| 共价键类型 | C-C | C=C | C-H |
| 键能kJ/mol | 332 | 611 | 414 |
| A、C3H8、C2H4、CH4互为同系物 |
| B、C-C比C=C更活泼 |
| C、若1 mol C3H8完全反应,能够吸收53 kJ的热量 |
| D、可用酸性高锰酸钾除去混合气体中的C2H4,得到纯净的CH4 |
下列各组离子在水溶液中不能发生反应的是( )
| A、Ag+、Cl- |
| B、H+、OH- |
| C、Na+、Cl- |
| D、Ba2+、SO42- |
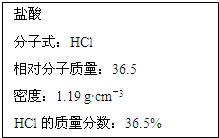 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: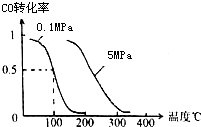 (1)在一定条件下,容积为 100L密闭容器中发生反应:
(1)在一定条件下,容积为 100L密闭容器中发生反应:
