题目内容
17.有关电解质的说法正确的是( )| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
分析 A.纯水能够电离出氢离子和氢氧根离子,属于极弱的电解质;
B.电解质必须本身能够电离;
C.电解质必须是化合物;
D.依据电解质概念判断.
解答 解:A.纯水能够电离出氢离子和氢氧根离子,属于极弱的电解质,故A错误;
B.SO3水溶液的导电性很好是因为三氧化硫与水反应生成电解质硫酸,而 SO3本身不能电离产生自由离子,所以属于非电解质,故B错误;
C.铜是单质,不是化合物,不是电解质,故C错误;
D.在水溶液中或熔融状态下能导电的化合物是电解质,而氧化钠为化合物,液态时能导电,符合电解质概念,是电解质,故D正确;
故选:D.
点评 本题考查了电解质、非电解质判断,熟悉概念是关键,注意电解质、非电解质必须是化合物,电解质必须本身能够电离,题目难度不大.

练习册系列答案
相关题目
13.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,22.4 L NH3中含有共价键的数目为3NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数目为0.5NA | |
| D. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA |
8. 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不退色.
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
12.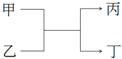 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )| A. | H2和Na | B. | S和O2 | C. | C和Si | D. | Cl2和Br2 |
7.下列说法正确的是( )
| A. | PCl5 分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移 | |
| B. | 两个原子间形成共价键时,最多可以有两个σ键 | |
| C. | H3O+中H-O-H的键角比H2O中H-O-H的键角大 | |
| D. | 酸性强弱比较:HClO>HClO2 |