题目内容
3.物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),则混合后溶液呈中性,醋酸体积大于 氢氧化钠溶液体积.分析 溶液中c(Na+)=c(CH3COO-),根据电荷守恒判断c(H+)、c(OH-)相对大小,从而确定溶液酸碱性;混合溶液呈中性,二者物质的量浓度相等,醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量应该稍微大些.
解答 解:物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+)=c(CH3COO-),根据电荷守恒可知:c(H+)=c(OH-),说明反应后溶液呈中性;
混合溶液呈中性,二者物质的量浓度相等,醋酸钠溶液呈碱性,要使混合溶液呈中性,醋酸的物质的量应该稍大些,所以醋酸溶液体积大于NaOH溶液体积,
故答案为:中性;大于;
点评 本题考查溶液酸碱性与溶液pH的计算、弱电解质的电离等知识,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
13.下列物质属于离子化合物的是( )
| A. | N2 | B. | NH3 | C. | HNO3 | D. | NH4Cl |
11.一气球若放在空气中静止不动,那么在相同条件下该气体放在下列气体中会下沉的是( )
| A. | CH4 | B. | SO2 | C. | CO2 | D. | O2 |
18.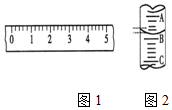 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(2)图2表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是3.2mL.
(3)用18mol•L-1的硫酸溶液配制0.5mol•L-1的硫酸溶液250mL所需的玻璃仪器为10mL量筒,250ml容量瓶,烧杯,玻璃棒,胶头滴管.
 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
(3)用18mol•L-1的硫酸溶液配制0.5mol•L-1的硫酸溶液250mL所需的玻璃仪器为10mL量筒,250ml容量瓶,烧杯,玻璃棒,胶头滴管.
8.如图,将铁棒(Fe)和石墨棒(C)插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( ) 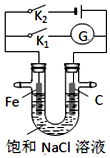

| A. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| B. | K1闭合,铁棒上发生的反应为2H++2e→H2↑ | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
13.下列说法正确的是( )
| A. | 氢氧化钠是离子化合物,该物质中只存在离子键 | |
| B. | 干冰在升华的过程中,只需要克服分子间作用力 | |
| C. | 12 C与 13 C由于核外电子排布不同,所以属于同位素 | |
| D. | 在 N2、CO2 和 SiO2 三种物质中,都存在共价键,它们都是由分子构成的物质 |
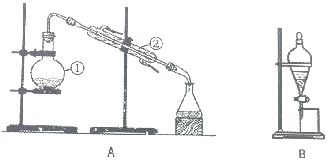 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.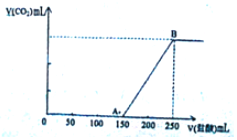 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示