题目内容
20.溶液中可以大量共存的一组离子是( )| A. | Al3+、Na+、OH-、Cl- | B. | H+、AlO2-、Na+、SO42- | ||
| C. | Mg2+、AlO2-、Al3+、NO3- | D. | OH-、AlO2-、K+、Na+ |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.Al3+和OH-不能共存,故A不选;
B.H+、AlO2-不能共存,故B不选;
C.AlO2-、Al3+相互促进水解生成沉淀,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应的离子反应的判断,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
11.下列化合物不能由两种单质直接化合而生成的是( )
| A. | Fe2S3 | B. | Na2S | C. | Cu2S | D. | FeCl3 |
8.可逆反应达到化学平衡状态的重要特征是( )
| A. | 反应停止了 | B. | 正、逆反应的速率都为0 | ||
| C. | 正、逆反应都还在进行 | D. | 正、逆反应的速率相等且不为0 |
5.下列说法正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,则H2燃烧热(△H)为-241.8kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)=2CO(g)的△H=+172.5kJ•mol-1 |
12.下列事实对应的离子方程式或电极反应式书写正确的是( )
| A. | 用石墨作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| D. | NaHSO4在水溶液中电离:NaHSO4=Na++HSO4- |
9.常温下,向25mL 0.1mol•L-1弱碱MOH溶液中逐滴滴加0.2mol•L-1的HCl,溶液pH的变化曲线如图所示(溶液混合时体积的变化忽略不计).下列说法正确的是( )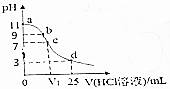

| A. | MOH电离方程式为:MOH═M++OH- | |
| B. | 在b点,离子浓度大小为c(OH-)>c(H+)>c(M+)>c(Cl-) | |
| C. | 在c点,滴加的V(HCl)>12.5mL | |
| D. | 在d点,c(Cl-)=2c(MOH)+2c(M+)=0.1mol•L-1 |
11.下列关于硅的化学性质的叙述,正确的是( )
| A. | 常温时不和任何酸反应 | B. | 常温时可和强碱溶液反应 | ||
| C. | 单质硅比碳的还原性弱 | D. | 单质硅比碳的氧化性强 |
 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中的数据分析:该反应的化学方程式为3X+Y?2Z.
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中的数据分析:该反应的化学方程式为3X+Y?2Z.