题目内容
12.下列事实对应的离子方程式或电极反应式书写正确的是( )| A. | 用石墨作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| B. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| D. | NaHSO4在水溶液中电离:NaHSO4=Na++HSO4- |
分析 A.石墨为惰性电极,阳极生成氧气,阳极铜离子得到电子生成铜;
B.碳酸根离子的水解分步进行,水解方程式写出第一步即可;
C.负极铁失去2个电子生成亚铁离子;
D.硫酸氢钠在溶液中完全电离出钠离子、氢离子和硫酸根离子,硫酸氢根离子应该拆开.
解答 解:A.用石墨作电极电解CuSO4溶液生成铜、氧气和硫酸,反应的离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,故A正确;
B.碳酸钠溶液中,碳酸根离子水解溶液显碱性,其水解主要以第一步为主,正确的水解反应为:CO32-+H2O?HCO3-+OH-,故B错误;
C.钢铁发生吸氧腐蚀时,铁作负极失去2个电子被氧化,正确的电极反应式为:Fe-2e-═Fe2+,故C错误;
D.NaHSO4在水溶液中电离出钠离子、氢离子和硫酸根离子,正确的电离方程式为:NaHSO4=Na++H++SO42-,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确盐的水解原理,C为易错点,注意钢铁腐蚀时生成的是亚铁离子.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
3.黑火药爆炸的反应为:2KNO3+3C+S═K2S+N2↑+3CO2↑,则被氧化的元素是( )
| A. | 碳和氢 | B. | 氮和硫 | C. | 只有硫 | D. | 只有碳 |
20.溶液中可以大量共存的一组离子是( )
| A. | Al3+、Na+、OH-、Cl- | B. | H+、AlO2-、Na+、SO42- | ||
| C. | Mg2+、AlO2-、Al3+、NO3- | D. | OH-、AlO2-、K+、Na+ |
7.下列说法正确的是( )
| A. | 铝、铁、铜相比较,铜元素在自然界中的含量最低、铁元素含量最高 | |
| B. | Al2O3、MgO可用作高温材料,二氧化硅是生产光纤制品的基本原料 | |
| C. | 工业上采用电解熔融态Al2O3、MgO的方法冶炼Al、Mg | |
| D. | 用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体 |
17.四种短周期元素在周期表中的位置如图,其中M为地壳中含量最高的金属元素.下列说法不正确的是( )
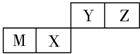

| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的弱 | |
| D. | Z位于元素周期表中第2周期、第ⅥA族 |
4.已知:2NaAlO2+CO2+3H2O=2A1(OH)3↓+Na2CO3,向含2molNaOH、1molBa(OH)2、2molNaAlO2的混合溶液中慢慢通人CO2,则通人CO2的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(CO2)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
2.在密闭容器中把CO和H2O的混合物加热到800℃,有下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),且平衡常数K=1.若在2L的密闭容器中充入1mol CO和1mol H2O相互混合并加热到800℃,则CO的转化率为( )
| A. | 40% | B. | 50% | C. | 60% | D. | 83.3% |
3.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | 使甲基橙呈红色的溶液:NO3-、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| D. | pH=12的溶液:CO32-、Cl-、K+、F- |
