题目内容
13.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又还原剂、既非氧化非还原剂等.下列反应与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用不相同的是( )| A. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | BrCl+H2O═HCl+HBrO | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
分析 反应Br2+SO2+2H2O═H2SO4+2HBr中,水中H和O元素化合价没有发生变化,水在反应中既非氧化剂又非还原剂,以此解答.
解答 解:反应Br2+SO2+2H2O═H2SO4+2HBr中,水中H和O元素化合价没有发生变化,水在反应中既非氧化剂又非还原剂,
A.水中H元素化合价降低,被还原,则水为氧化剂,故A选;
B.水中H和O元素化合价没有发生变化,水在反应中既非氧化剂又非还原剂,故B不选;
C.水中H和O元素化合价没有发生变化,水在反应中既非氧化剂又非还原剂,故C不选;
D.水中H和O元素化合价没有发生变化,Na2O2自身发生氧化还原反应,水在反应中既非氧化剂又非还原剂,故D不选.
故选:A.
点评 本题考查氧化还原反应,侧重于相关概念的考查,题目难度不大,注意从元素化合价的角度认识,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列实验操作中叙述正确的是( )
| A. | 萃取操作必须在分液漏斗中进行 | |
| B. | 分液操作时上层液体从上口倒出,下层液体从下口流出 | |
| C. | 蒸馏属于化学变化,分液属于物理变化 | |
| D. | 蒸馏时接收冷凝出的液体常用烧杯代替锥形瓶 |
18.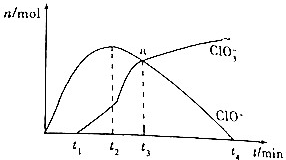 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )| A. | 参加反应所需要NaOH与氯气的物质的量之比一定为2:1 | |
| B. | a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 | |
| C. | t2~t4min,ClO-的物质的量下降的原因可能是3ClO-═2Cl-+ClO${\;}_{3}^{-}$ | |
| D. | 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
4.同温同压下,体积相同的两个容器,一个充满NO,另外一个充满N2 和O2的混合气体,这两个容器中一定相同的是( )
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
 .
. 的系统命名为3-甲基-戊烷.
的系统命名为3-甲基-戊烷. .
. 中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子. ;
;