题目内容
12. 在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )| A. | 6:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
分析 首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,据此确定溶液中n(Mg2+):n(Al3+),据此计算解答.
解答 解:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,则沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(Mg2+):n(Al3+)=$\frac{1}{2}$×20mL:$\frac{1}{3}$×30mL=1:1,原来混合溶液中Al2(SO4)3和MgSO4的物质的量之比为$\frac{1}{2}$:1=1:2,
由于在同一溶液中,物质的量浓度之比等于物质的量之比,所以原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为1:2,
故选B.
点评 本题考查了离子方程式的计算,题目难度中等,明确图象曲线变化对应反应原理为解答关键,注意掌握氢氧化铝的化学性质,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
20.以下互为同位素的是( )
| A. | 石墨与金刚石 | B. | 1735Cl和1737Cl | C. | CO和CO2 | D. | 1H2、2D2和3T2 |
4.同温同压下,体积相同的两个容器,一个充满NO,另外一个充满N2 和O2的混合气体,这两个容器中一定相同的是( )
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
1.下列各组物质中,化学键完全相同的是( )
| A. | NaCl和NaOH | B. | Cl2和N2O | C. | Na2S和(NH4)2S | D. | H2O2和Na2O2 |
 .
. 的系统命名为3-甲基-戊烷.
的系统命名为3-甲基-戊烷. .
. 中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,共直线的原子最多有5个,该分子中有4种不同化学环境的H原子.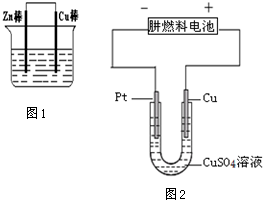
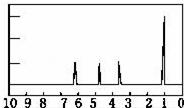 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.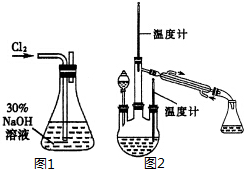 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).