题目内容
13.资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如下(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.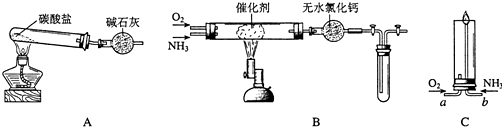
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是(NH4)2CO3或NH4HCO3;碱石灰的作用是吸收CO2和H2O,得到纯净的NH3.
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是先通入O2,后通入NH3;其理由是若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染.
②氨气燃烧的化学方程式是4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$?2N2+6H2O.
分析 (1)依据碳酸铵、碳酸氢铵不稳定受热分解生成氨气的性质解答;氨气为碱性气体,应选择碱性干燥剂,结合碱石灰的成分及性质解答;
(2)氨气催化氧化生成一氧化氮和水;
(3)①若先通入NH3,NH3在空气中不能点燃,氨气可在纯氧中安静燃烧,依次进行判断;
②NH3中N元素的化合价为-3价,为最低价态,具有还原性,在点燃条件下生成N2和水.
解答 解:(1)碳酸铵、碳酸氢铵不稳定受热分解生成氨气,据此可以用(NH4)2CO3或NH4HCO3加热制备氨气;氨气为碱性气体,应选择碱性干燥剂,碱石灰主要成分为氢氧化钠和氧化钙,为碱性干燥剂,可干燥氨气吸收生成的二氧化碳;
故答案为:(NH4)2CO3或NH4HCO3;吸收CO2和H2O,得到纯净的NH3;
(2)氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2 $\frac{\underline{催化剂}}{△}$ 4NO+6H2O;
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$ 4NO+6H2O;
(3)①要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
故答案为:先通入O2,后通入NH3;若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
②氨气在氧气中燃烧生成氮气和水,方程式:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$?2N2+6H2O;
故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$?2N2+6H2O.
点评 本题为信息题,考查了氨气的制备和性质的检验,准确把握信息,熟悉氨气制备原理和性质是解题关键,题目难度不大.

练习册系列答案
相关题目
3.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 温度升高到50℃,两溶液的pH均不会发生变化 | |
| C. | 用同浓度的盐酸中和,消耗的盐酸体积相同 | |
| D. | 分别加水稀释到10倍体积,稀释后两溶液的pH仍相等 |
4.火法炼铜需要焙烧黄铜矿,发生的反应为2CuFeS2+O2═Cu2S+2FeS+SO2.关于该反应,下列说法不正确的是( )
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂,其中硫元素被还原 | |
| C. | FeS既不是氧化产物也不是还原产物 | |
| D. | 在转移了3mol电子的同时,有0.5 mol的SO2生成 |
1.化学在日常生产生活中有着重要的应用.下列说法不正确的是( )
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 在海轮外壳上镶入锌块,锌作负极,可减缓船体的腐蚀速率 | |
| D. | 在潮湿的空气中,镀锌铁板比镀锡铁板更耐腐蚀 |
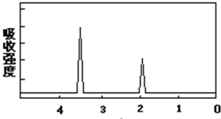 某有机物的分子式是C2H6O2,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,其核磁共振氢普如图所示.该有机物的结构简式是HOH2C-CH2OH.
某有机物的分子式是C2H6O2,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,其核磁共振氢普如图所示.该有机物的结构简式是HOH2C-CH2OH.