题目内容
15.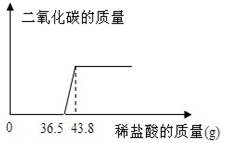 欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下:
欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下:(1)求反应完毕后产生二氧化碳的质量?
(2)原固体中氢氧化钠的质量分数是多少?(结果保留一位小数)
分析 根据图象可知,无气体放出段消耗的盐酸的质量为36.5g,大于有气体放出段所消耗的盐酸的质量7.3g,故可知样品为NaOH和Na2CO3的混合物.且稀盐酸先和氢氧化钠反应,再和Na2CO3反应生成NaHCO3,此过程无气体放出,共消耗盐酸36.5g;然后盐酸和NaHCO3反应生成CO2气体,此过程消耗盐酸7.3g.根据NaHCO3消耗的稀盐酸的质量,即可求出生成CO2的物质的量和质量以及NaHCO3的物质的量,而Na2CO3的物质的量等于NaHCO3的物质的量,即可求出样品中Na2CO3的质量,然后结合NaOH和Na2CO3的混合物反应至有恰好气体放出时共消耗盐酸36.5g,即可求出样品中NaOH的物质的量和质量,从而能求出样品中氢氧化钠的质量分数.
解答 解:根据图象可知,在消耗盐酸0-36.5g段内发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+NaHCO3.
消耗盐酸36.5g-43.8g段内发生的反应为:NaHCO3++HCl=NaCl+CO2↑+H2O.
设样品中的NaOH的物质的量为xmol,Na2CO3的物质的量为ymol.
(1)在生成二氧化碳过程中消耗的盐酸的质量为43.8g-36.5g=7.3g,由于盐酸的质量分数为10%,故盐酸溶液中含有的n(HCl)=$\frac{7.3g×10%}{36.5g/mol}$=0.02mol.由于Na2CO3的物质的量为ymol,则经过反应Na2CO3+HCl=NaCl+NaHCO3生成的NaHCO3的物质的量也为ymol.设生成的二氧化碳的物质的量为zmol.则有:
根据反应可知:NaHCO3++HCl=NaCl+CO2↑+H2O
1 1 1
ymol 0.02mol zmol
故可知:$\frac{1}{y}=\frac{1}{0.02}=\frac{1}{z}$
解得y=0.02mol,z=0.02mol.
故生成的二氧化碳的质量m=nM=0.02mol×44g/mol=0.88g.
答:生成的二氧化碳的质量为0.88g.
(2)由于y=0.02mol,即样品中的Na2CO3的物质的量为0.02mol,消耗盐酸0-36.5g段内消耗的盐酸的质量为36.5g,含有的HCl的物质的量n(HCl)=$\frac{36.5g×10%}{36.6g/mol}$=0.1mol.由于消耗盐酸0-36.5g段内发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3 +HCl=NaCl+NaHCO3.
1 1 1 1
xmol xmol 0.02mol 0.02mol
故可知消耗的盐酸的物质的量n(HCl)=0.1mol=xmol+0.02mol
解得x=0.08mol.
即样品中m(NaOH)=nM=0.08mol×40g/mol=3.2g.
而样品中Na2CO3的物质的量为0.02mol,质量为m(Na2CO3)=2.12g.
故样品中NaOH的质量分数=$\frac{3.2g}{3.2g+2.12g}×100%$=61.3%.
答:样品中氢氧化钠的质量分数为61.3%.
点评 本题难度不是很大,主要考查了质量守恒定律的应用和根据化学方程式的计算,培养学生分析问题的能力和解决问题的能力.

(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 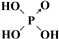 | 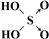 | 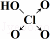 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O. | A. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 温度升高到50℃,两溶液的pH均不会发生变化 | |
| C. | 用同浓度的盐酸中和,消耗的盐酸体积相同 | |
| D. | 分别加水稀释到10倍体积,稀释后两溶液的pH仍相等 |
| A. | 先后通入溴水和澄清石灰水 | |
| B. | 点燃后罩上涂有澄清石灰水的烧杯,通入溴水 | |
| C. | 点燃后罩上干燥的冷烧杯 | |
| D. | 点燃后罩上涂有澄清石灰水的烧杯 |
| A. | 44.5kJ/mol | B. | 1364.7kJ/mol | C. | 2729.3kJ/mol | D. | 89.0kJ/mol |
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂,其中硫元素被还原 | |
| C. | FeS既不是氧化产物也不是还原产物 | |
| D. | 在转移了3mol电子的同时,有0.5 mol的SO2生成 |
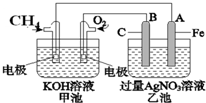 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为