题目内容
14.化学与社会生产、生活密切相关,下列说法不正确的是( )| A. | 糖类是动、植物所需能量的重要来源,油脂是产生能量最高的营养物质 | |
| B. | 化石燃料的大量使用是产生PM2.5的主要原因之一 | |
| C. | 碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 |
分析 A.几种主要的营养物质中,等质量的情况下,油脂放出的热量最多;
B.PM2.5主要来源,是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物;
C.碳酸钠溶液显碱性,能清洗油污;
D.青铜为最早使用的金属材料,用量最大的合金材料是钢铁.
解答 解:A.基本营养物质有糖类、油脂、蛋白质等,其中单位质量的油脂产生的能量最高,故A正确;
B.化石燃料的大量使用是产生PM2.5的主要原因之一,故B正确;
C.碳酸钠俗名纯碱,也叫苏打,碳酸钠溶液显碱性,能清洗油污,故C正确;
D.青铜为最早使用的金属材料,目前世界上使用量最大的合金材料是钢铁,不是铝合金,故D错误.
故选D.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题:
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸(H3PO3)也是中强酸,它的结构式为 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 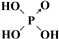 | 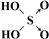 | 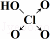 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
2.下列离子方程式不正确的是( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
3.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 温度升高到50℃,两溶液的pH均不会发生变化 | |
| C. | 用同浓度的盐酸中和,消耗的盐酸体积相同 | |
| D. | 分别加水稀释到10倍体积,稀释后两溶液的pH仍相等 |
4.火法炼铜需要焙烧黄铜矿,发生的反应为2CuFeS2+O2═Cu2S+2FeS+SO2.关于该反应,下列说法不正确的是( )
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂,其中硫元素被还原 | |
| C. | FeS既不是氧化产物也不是还原产物 | |
| D. | 在转移了3mol电子的同时,有0.5 mol的SO2生成 |
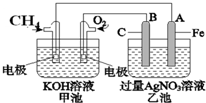 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为