题目内容
20.25℃时,用如图所示装置除去含CN-、Cl-废水中CN-时,控制pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
| A. | 可用石墨做阳极,铁做阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O | |
| C. | 若铁做阴极,则电解过程中溶液中的阳离子向铁电极运动 | |
| D. | 除去CN-的反应,2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
分析 根据装置图,该电解质溶液呈碱性,电解时,阳极要生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,据此分析.
解答 解:A.根据装置图,该电解质溶液呈碱性,电解时,阳极要生成氯气,所以铁不能作阳极,石墨做阳极,铁做阴极,故A正确;
B.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故B正确;
C.若铁做阴极,电解过程中溶液中的阳离子移向阴极,即阳离子向铁电极运动,故C正确;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故D错误;
故选:D.
点评 本题主要考查电解原理,明确各个电极上发生的反应及电解原理是解本题关键,易错选项是D,注意D中碱性条件下不能有氢离子参加反应或生成.

练习册系列答案
相关题目
10.为达到相应的实验目的,下列实验的设计或操作最合理的是( )
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧 | |
| C. | 为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
8.下表是元素周期表的一部分,回答下列问题:
(1)写出②⑧⑩三种元素分别为N;Si;S.
(2)写出①、③两种元素形成的化合物有两种,化学式:CO,CO2.
(3)写出①元素最高价氧化物的电子式和结构式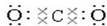 ,O=C=O.
,O=C=O.
(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出①、③两种元素形成的化合物有两种,化学式:CO,CO2.
(3)写出①元素最高价氧化物的电子式和结构式
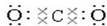 ,O=C=O.
,O=C=O.(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
15.现有可逆反应A(g)+2B(g)?nC(g)△H<0,在相同温度、不同压强时,A的质量分数跟反应时间(t)的关系如图所示,其中结论正确的是( )

| A. | p1>p2,n>3 | B. | p1>p2,n<3 | C. | p1<p2,n>3 | D. | p1<p2,n<3 |
9.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示,下列说法不正确的是( )

| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
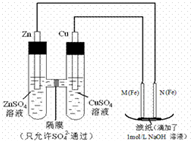 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.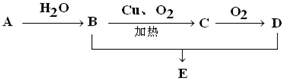 如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.
如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.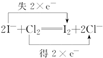 .
.