题目内容
5.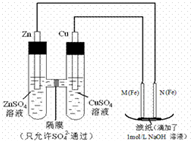 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.请回答:
用如图所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是A(填字母序号).A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为2H2O+2e-=H2↑+2OH-.
(3)实验过程中,SO42-从右向左(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有滤纸上有红褐色斑点产生.
分析 图中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动,据此分析.
解答 解:(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,
故答案为:A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),
故答案为:2H2O+2e-═H2↑+2OH-;
(3)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生,
故答案为:从右向左; 滤纸上有红褐色斑点产生.
点评 本题考查了原电池和电解池原理,侧重于学生的分析能力的考查,注意电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点,题目难度中等.

练习册系列答案
相关题目
15.下列做法会对人体健康造成较大危害的是( )
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 硅胶常用作食品、药品干燥剂 | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
13.有一种银锌电池,其电极分别为Ag2O和ZnO,电解质溶液为KOH,电极反应式分别为:
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
20.25℃时,用如图所示装置除去含CN-、Cl-废水中CN-时,控制pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )

| A. | 可用石墨做阳极,铁做阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O | |
| C. | 若铁做阴极,则电解过程中溶液中的阳离子向铁电极运动 | |
| D. | 除去CN-的反应,2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
10.下列说法错误的是( )
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
17.硫黄制酸在我国的工业发展进程中具有重要地位,其工业流程示意图如下.已知硫磺的燃烧热△H=-297kJ•mol-1.下列说法正确的是( )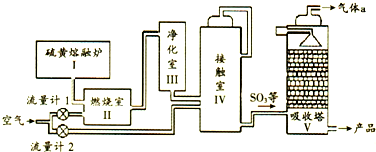

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
14.下列各组化合物中,有关化学键类型的叙述正确的是( )
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
19.下表列出了A~R九种元素在周期表的位置:
(1)写出EF2分子的电子式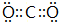 .
.
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)H、I、G三种元素的最高价氧化物对应的水化物中酸性由大到小的顺序排列为Cl>S>Si.(只填写元素符号)
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)H在元素周期表中位置第3周期第IVA族:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
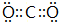 .
.(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)H、I、G三种元素的最高价氧化物对应的水化物中酸性由大到小的顺序排列为Cl>S>Si.(只填写元素符号)
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)H在元素周期表中位置第3周期第IVA族: