题目内容
15.现有可逆反应A(g)+2B(g)?nC(g)△H<0,在相同温度、不同压强时,A的质量分数跟反应时间(t)的关系如图所示,其中结论正确的是( )
| A. | p1>p2,n>3 | B. | p1>p2,n<3 | C. | p1<p2,n>3 | D. | p1<p2,n<3 |
分析 由图可知压强为p2先到达平衡,根据“先拐先平数值大”,则p2>p1,压强越大A的质量分数越小,增大压强平衡向正反应方向移动,据此判断n的值.
解答 解:由图可知压强为p2先到达平衡,根据“先拐先平数值大”,则p2>p1,压强越大A的质量分数越小,增大压强平衡向正反应方向移动,增大压强平衡向气体气体减小的方向移动,即3>n,故选D.
点评 本题考查化学平衡影响影响因素,难度中等,注意根据“先拐先平数值大”判断压强,再根据压强对平衡的影响解答.

练习册系列答案
相关题目
6.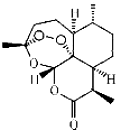 屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
 屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )
屠呦呦因发现和提取青蒿素在治疟疾方面的杰出贡献获得2015年诺贝尔生理学或医学奖.青蒿素分子式为C15H22O5,结构式如图.下列说法正确的是( )| A. | 青蒿素是无机物 | |
| B. | 青蒿索的摩尔质量为282 | |
| C. | 屠呦呦发现用乙醚提取青蒿素效果很好,表明青蒿素难溶于水,易溶于乙醚,在水中溶解度不大 | |
| D. | 屠呦呦获得的是诺贝尔生理学或医学奖,说明无需学好化学,也能在医学上取得非凡的成绩 |
3.下列选项错误的是( )
| A. | NaCl属于离子化合物 | B. | 原子团为OH-属于羟基 | ||
| C. | 乙醇与水混合后静置,不出现分层 | D. | 淀粉水解的最终产物含有葡萄糖 |
20.25℃时,用如图所示装置除去含CN-、Cl-废水中CN-时,控制pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )

| A. | 可用石墨做阳极,铁做阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O | |
| C. | 若铁做阴极,则电解过程中溶液中的阳离子向铁电极运动 | |
| D. | 除去CN-的反应,2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
7.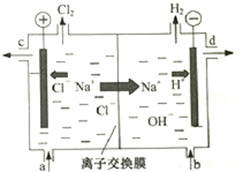 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
完成下列填空:
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)精制饱和食盐水从图中a位置补充,氢氧化钠溶液从图中d位置流出.(选填“a”、“b”、“c”或“d”)
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质.写出该反应的化学方程式2KClO3+H2C2O4+2H2SO4=2ClO2+2CO2+2KHSO4+2H2O.
(4)已知室温下几种弱酸的平衡常数:
则0.1mol/L NaClO溶液的pH>0.1mol/L Na2SO3溶液的pH.(选填“大于”、“小于”或“等于”).浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3- 浓度从大到小的顺序为c(SO32-)>c(CO32-)c(HCO3-)>c(HSO3-).
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)精制饱和食盐水从图中a位置补充,氢氧化钠溶液从图中d位置流出.(选填“a”、“b”、“c”或“d”)
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质.写出该反应的化学方程式2KClO3+H2C2O4+2H2SO4=2ClO2+2CO2+2KHSO4+2H2O.
(4)已知室温下几种弱酸的平衡常数:
| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
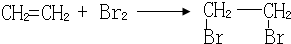 ;
; ;
;


 .
. (任意一种)(任写一种).
(任意一种)(任写一种). $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.