题目内容
9.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示,下列说法不正确的是( )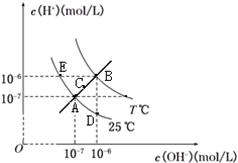
| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
分析 由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液.
解答 解:A.由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则B>A=D=E,由C点c(OH-)×c(H+)可知,C点的Kw大于A点小于B,所以B>C>A=D=E,故A正确;
B.E点c(OH-)<c(H+),溶液呈酸性,酸性条件下,NH4+、Ba2+、Cl-、I-没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故B正确;
C.B点时,Kw=1×10-12,pH=3的硫酸中c(H+)=0.001mol/L,与pH=9的KOH溶液中c(OH-)=0.001mol/L,等体积混合后,溶液显中性,故C正确;
D.D点溶液中c(OH-)>c(H+),溶液呈碱性,说明HB-的水解程度大于电离程度,所以c(B2-)<c(H2B),故D错误;
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断及计算能力,注意分析图象,把握水的离子积只受温度的影响,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
19.下列有关物质检验的实验结论正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液不显红色.再向溶液中加入几滴新制氯水,溶液变为红色. | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入到品红溶液中,品红褪色 | 该气体一定为SO2 |
| D | 向某溶液中滴入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
20.25℃时,用如图所示装置除去含CN-、Cl-废水中CN-时,控制pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )

| A. | 可用石墨做阳极,铁做阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-=ClO-+H2O | |
| C. | 若铁做阴极,则电解过程中溶液中的阳离子向铁电极运动 | |
| D. | 除去CN-的反应,2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
17.硫黄制酸在我国的工业发展进程中具有重要地位,其工业流程示意图如下.已知硫磺的燃烧热△H=-297kJ•mol-1.下列说法正确的是( )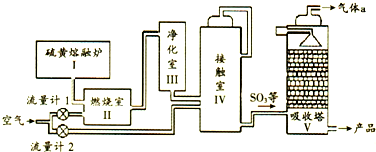

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
14.下列各组化合物中,有关化学键类型的叙述正确的是( )
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
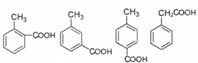
1.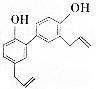 中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
下列有关该物质的叙述正确的是( )
 中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.下列有关该物质的叙述正确的是( )
| A. | 1个厚朴酚分子中含有16个碳原子 | |
| B. | 厚朴酚能使酸性KMnO4溶液褪色,遇FeCl3溶液显色 | |
| C. | 1mol厚朴酚与足量NaHCO3溶液反应放出22.4LCO2(标准状况) | |
| D. | 1mol厚朴酚能与4molBr2(Br2的CCl4溶液)反应 |
2.下列粒子中核外电子数相同的是( )
①Al3+ ②○2- ③Cl- ④F-.
①Al3+ ②○2- ③Cl- ④F-.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
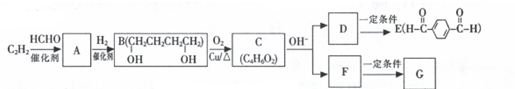

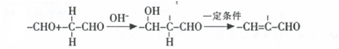
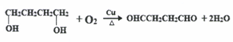 .
. (任意一种)(任写一种).
(任意一种)(任写一种). $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$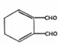 +H2O.
+H2O.