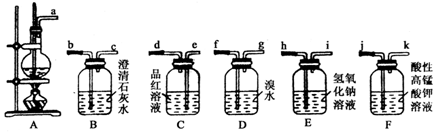
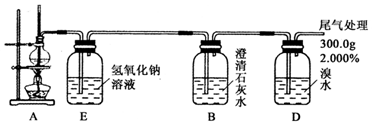
题目内容
3.弱酸弱碱盐溶液显( )性.| A. | 一定显酸性 | B. | 一定显碱性 | ||
| C. | 一定显中性 | D. | 可能显酸性、碱性或中性 |
分析 弱酸弱碱盐溶液中弱碱阳离子水解显酸性,弱酸阴离子水解显碱性,二者水解程度大小不同,溶液酸碱性不同.
解答 解:弱酸弱碱盐溶液中弱碱阳离子水解显酸性,弱酸阴离子水解显碱性,二者水解程度大小不同,溶液酸碱性不同,若弱碱阳离子水解程度大,溶液显酸性,弱弱酸阴离子水解程度大溶液显碱性,弱二者水解程度相近,溶液显中性,故选D.
点评 本题考查了盐类水解原理的分析判断,注意水解实质是弱离子促进水电离平衡正向进行,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.实验室保存下列物质的方法中,正确的是( )
| A. | 碳酸钠溶液盛装在用玻璃塞的试剂瓶中 | |
| B. | 氢氟酸盛装在玻璃瓶中 | |
| C. | 金属钠保存在煤油中 | |
| D. | 硝酸银固体存放在细口瓶中 |
14.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液、⑥蒸发、结晶.正确的操作顺序是( )
| A. | ①④②⑤③⑥ | B. | ④①②⑤③⑥ | C. | ⑤②④①③⑥ | D. | ⑤②④③①⑥ |
11.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀速率最慢的是( )
| A. | 在酸性土地中 | |
| B. | 在潮湿疏松的土壤中 | |
| C. | 在干燥致密不透气的土壤中 | |
| D. | 在含碳粒较多,潮湿透气的中性土壤中 |
18.能正确表示下列反应的离子方程式是( )
| A. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与硫酸铜溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 过量铁与稀硝酸反应:3Fe+8H++2NO3-═3Fe2++4H2O+2NO↑ | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+HSO4-═BaSO4↓+H2O |
15.常温下,由水电离出C(H+)=1×10-13mol/L溶液中,一定能大量共存是( )
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO32-、MnO4- | ||
| C. | Al3+、Na+、AlO2-、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
12.下列有关溶液中粒子浓度关系的叙述正确的是( )
| A. | 0.1 mol•L-1 NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 向10 mL 0.2 mol•L-1 NaCl溶液中滴入2 mL 0.1 mol•L-1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |