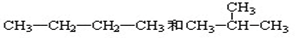题目内容
14.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液、⑥蒸发、结晶.正确的操作顺序是( )| A. | ①④②⑤③⑥ | B. | ④①②⑤③⑥ | C. | ⑤②④①③⑥ | D. | ⑤②④③①⑥ |
分析 除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后可除去过量的氯化钡,过滤后加盐酸、蒸发得到NaCl,以此来解答.
解答 解:除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后可除去过量的氯化钡,过滤后加盐酸、蒸发得到NaCl,则正确的操作顺序为⑤②④①③⑥或②⑤④①③⑥.
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握元素化合物知识、除杂的原则及试剂加入顺序为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
9.下列说法中一定正确的是( )
| A. | pH=5的溶液中c(H+)=1.0×10-5 mol•L-1 | |
| B. | pH=7的溶液呈中性 | |
| C. | pH值为0的溶液中c(H+)=0 mol/L | |
| D. | pH=5的溶液中c(OH-)=1.0×10-9 mol•L-1 |
19.下列说法中有明显错误的是( )
| A. | 对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 有效碰撞一定在活化分子之间,活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
3.弱酸弱碱盐溶液显( )性.
| A. | 一定显酸性 | B. | 一定显碱性 | ||
| C. | 一定显中性 | D. | 可能显酸性、碱性或中性 |
4.室温下,分别用0.1mol•L-1溶液进行下列实验,结论不正确的是( )
| A. | 向NaOH溶液中通SO2至pH=7:c(Na+)═c(HSO3-)+2c(SO32-) | |
| B. | 向NH4Cl溶液中加入等浓度等体积的NH3•H2O后,所得溶液呈碱性,则:c(NH4+)<c(NH3•H2O) | |
| C. | 向NH4HSO4加入等浓度等体积的NaOH溶液后后:c(NH4+)+c(NH3•H2O)═c(Na+) | |
| D. | 向CH3COOH溶液中加入少量CH3COONa晶体:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ 增大 |
 氢气是一种高能燃料,也广范应用在工业合成中.
氢气是一种高能燃料,也广范应用在工业合成中.