题目内容
20.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: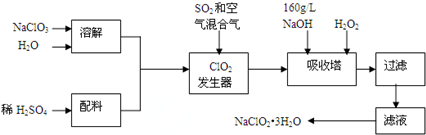
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下.
(1)发生器中发生反应的离子方程式为2ClO3-+SO2=2ClO2+SO42-.发生器中鼓入空气的作用可能是c.
a.将SO2氧化成SO3,增强酸性 b.将NaClO3还原为ClO2 c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;吸收塔内的温度不能超过20℃,其目的是防止H2O2分解.
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.以下还可以选择的还原剂是a(选填序号).
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是蒸发浓缩、冷却结晶、过滤.
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250ml待测溶液.(已知:ClO2-+4I-+4H+═2H2O+2I2+Cl-)
b.移取25.00ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml.(已知:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象为滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色.
②该样品中NaClO2的质量分数为$\frac{22.625cV}{m}$%(用含m、c、V的代数式表示,结果化成最简.)
分析 过氧化氢法生产亚氯酸钠,由流程可知,NaClO3溶解后与硫酸发生氧化还原反应生成ClO2,结合信息②可知混合气体稀释ClO2,吸收塔内发生2NaOH+2ClO2+H2O2═2NaClO2+2H2O+O2,过滤后,结合信息①可知,滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NaClO2•3H2O,
(1)ClO2发生器中NaClO3与SO2发生氧化还原反应生成ClO2和Na2SO4;由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答;
(2)根据题目信息并运用氧化还原反应理论判断反应物、生成物;根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,据此书写方程式;温度过高,H2O2容易分解;
(3)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体;
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,计算得到NaClO2的质量分数.
解答 解:过氧化氢法生产亚氯酸钠,由流程可知,NaClO3溶解后与硫酸发生氧化还原反应生成ClO2,结合信息②可知混合气体稀释ClO2,吸收塔内发生2NaOH+2ClO2+H2O2═2NaClO2+2H2O+O2,过滤后,结合信息①可知,滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NaClO2•3H2O,
(1)ClO2发生器中NaClO3与SO2发生氧化还原反应生成ClO2和Na2SO4,其反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-;
由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,
故答案为:2ClO3-+SO2=2ClO2+SO42-;c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;
H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;防止H2O2分解;
(3)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2;Na2S、FeCl2还原性较强,而生成物与NaClO2分离比较困难,
故答案为:a;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,
故答案为:蒸发浓缩、冷却结晶、过滤.
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
故答案为:滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为$\frac{\frac{1}{4}×90.5cV×1{0}^{-2}g}{mg}$×100%=$\frac{22.625cV}{m}$%;
故答案为:$\frac{22.625cV}{m}$%.
点评 本题考查物质制备,综合性较强,涉及氧化还原反应、物质分离和提纯的综合应用含量测定方法和计算,明确物质性质及实验基本操作原理是解本题关键,需要学生较强的综合能力,题目难度中等.

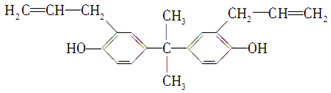
| A. | 该化合物属于芳香烃 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 双酚A不能使溴水褪色,但能使酸性高锰酸钾溶液褪色 | |
| D. | 1 mol双酚A最多可与2 mol H2发生加成反应 |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g.cm-3) | 水溶性 | |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
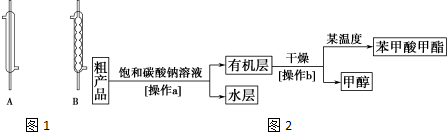
(1)实验中,应选择(如图1)B(填序号)作为冷凝回流装置,该仪器的名称为球形冷凝管.
(2)使用过量甲醇的原因是甲醇沸点低,损失大;甲醇过量可以提高苯甲酸的利用率.
Ⅱ.粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图2进行精制.
(3)饱和碳酸钠溶液的作用是除去苯甲酸甲酯中的杂质苯甲酸,溶解甲醇,降低苯甲酸甲酯溶解度,操作a的名称为分液.
(4)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论从分液漏斗下口放出少量液体,置于试管中,加入适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层.
(5)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为61.0%.
已知:
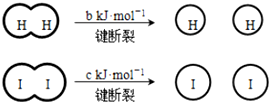 (a、b、c均大于零) 下列说法不正确的是( )
(a、b、c均大于零) 下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开 1 mol H-H 键和1 mol I-I键所需能量大于断开 2 mol H-I键所需能量 | |
| C. | 断开 2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于 2a kJ |
| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示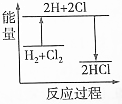 |
 .
.