题目内容
3.为探究苯与溴的取代反应,甲用下图装置Ⅰ进行如下实验: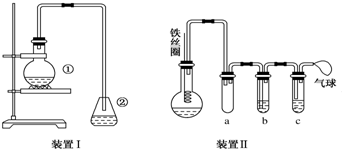
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3~5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
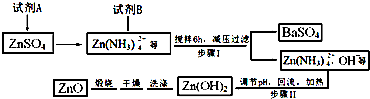
(1)装置Ⅰ中①的化学方程式为2Fe+3Br2═2FeBr3,
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓.(2)①中长导管的作用是导气兼冷凝回流.
(3)烧瓶中生成的红褐色油状液滴的成分是
 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物.原因是挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀.
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.a的作用是防止倒吸安全装置.b中的试剂是苯或四氯化碳.比较两套装置,装置Ⅱ的主要优点是防止倒吸、可以控制反应进行程度.
分析 (1)溴与铁反应生成溴化铁,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢;溴离子与银离子生成了溴化银沉淀;
(2)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液;
(4)验证先首先要除杂,否则挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀;
(5)支管是短进短出a的作用是防止倒吸安全装置;b中要除去Br2,b中试剂为苯或四氯化碳,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气.
解答 解:(1)因溴与铁反应生成溴化铁:2Fe+3Br2 ═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢: ;②中反应的离子方程式为Br-+Ag+═AgBr↓,
;②中反应的离子方程式为Br-+Ag+═AgBr↓,
故答案为:2Fe+3Br2═2FeBr3, ;Br-+Ag+═AgBr↓;
;Br-+Ag+═AgBr↓;
(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气,冷凝回流,
故答案为:导气兼冷凝回流;
(3)反应生成的溴苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,
故答案为: 与Br2;分液漏斗;
与Br2;分液漏斗;
(4)验证先首先要除杂,否则挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀,
故答案为:挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀;
(5)从图上信息可知,支管是短进短出a的作用是防止倒吸安全装置.b中要除去Br2,试剂为苯或四氯化碳.根据以上分析,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气,
故答案为:防止倒吸安全装置;苯或四氯化碳;防止倒吸、可以控制反应进行程度.
点评 本题主要考查了苯的性质实验,为高频考点,侧重于学生的分析能力和实验能力的考查,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,题目难度中等.

| A. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热) | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H(中和热) | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H (燃烧热) | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热) |
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g.cm-3) | 水溶性 | |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
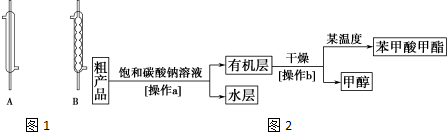
(1)实验中,应选择(如图1)B(填序号)作为冷凝回流装置,该仪器的名称为球形冷凝管.
(2)使用过量甲醇的原因是甲醇沸点低,损失大;甲醇过量可以提高苯甲酸的利用率.
Ⅱ.粗产品的精制 苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图2进行精制.
(3)饱和碳酸钠溶液的作用是除去苯甲酸甲酯中的杂质苯甲酸,溶解甲醇,降低苯甲酸甲酯溶解度,操作a的名称为分液.
(4)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论从分液漏斗下口放出少量液体,置于试管中,加入适量水,振荡、静置,若液体分层,则有机层在下层,若液体不分层,则有机层在上层.
(5)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为61.0%.
已知:
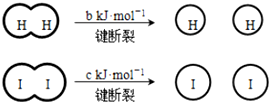 (a、b、c均大于零) 下列说法不正确的是( )
(a、b、c均大于零) 下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开 1 mol H-H 键和1 mol I-I键所需能量大于断开 2 mol H-I键所需能量 | |
| C. | 断开 2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于 2a kJ |
| A. | 电子从3s能级跃迁到3p能级形成的光谱是发射光谱 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为109°28′ | |
| C. | NO2- 中心原子采取sp2杂化,分子空间构型为“V”形 | |
| D. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |