题目内容
2.H2S分子中H-S键的键角为92°,说明H2S分子是极性(选填“极性”“非极性”)分子.可用FeS与稀硫酸制取 H2S气体,而CuS不溶于稀硫酸,请据此比较FeS、H2S、CuS这三种物质电离或溶解出S2-的能力FeS>H2S>CuS.实验室制取并收集H2S气体,除FeS和稀硫酸外,还必需的试剂是NaOH溶液.(1)在NaOH和NaClO混合溶液中,多硫化钠(Na2SX)会被氧化为Na2SO4,此时1molNa2SX失去的电子数为6x+2mol;若Na2SX与NaClO反应的物质的量之比为1:10,则 x=3.
(2)往Na2S和Na2S2O3混合溶液中加入稀硫酸,指出反应现象有淡黄色沉淀生成;可能产生臭鸡蛋气味的气体,也可能产生刺激性气味的气体.
(3)已知25℃:H2S Ki1=9.1×10-8 Ki2=1.1×10-12;H2SO3 Ki1=1.5×10-2 Ki2=1.0×10-7将amolSO2通入含bmolNa2S的溶液中完全反应,若没有硫化氢气体产生,则a:b的值为≥1.5.
分析 非极性分子的结构往往具有很强的对称性,据此判断;物质的溶解能力强,电离出硫离子的能力大,根据硫化氢气体有毒,需要进行尾气处理知识来回答;
(1)反应中元素化合价升高值=转移电子数=失电子数,根据氧化还原反应中电子守恒来计算回答;
(2)往Na2S和Na2S2O3混合溶液中加入稀硫酸,Na2S和硫酸反应可以得到硫化氢气体,Na2S2O3溶液中加入稀硫酸,可以得到硫单质和二氧化硫气体,硫离子和硫代硫酸根离子之间反应,可以得到硫单质;
(3)根据反应:2H2O+SO2+2Na2S=S↓+4NaOH,当二氧化硫的量过量时,则不会出现硫化氢的气体.
解答 解:非极性分子的结构往往具有很强的对称性,键角是120°、180°、109.5°等,H2S分子中H-S键的键角为92°,说明H2S分子是极性分子;物质的溶解能力强,电离出硫离子的能力大,FeS与稀硫酸制取 H2S气体,而CuS不溶于稀硫酸,反应强酸可以制取弱酸,所以三种物质电离或溶解出S2-的能力FeS>H2S>CuS,硫化氢气体有毒,需要用氢氧化钠溶液进行尾气处理,故答案为:极性;FeS>H2S>CuS;NaOH溶液;
(1)在NaOH和NaClO混合溶液中,多硫化钠(Na2SX)会被氧化为Na2SO4,此时1molNa2SX失去的电子数为=S元素化合价升高值=转移电子数=6x+2,若Na2SX与NaClO反应的物质的量之比为1:10,根据氧化还原反应中电子守恒,则:6x+2=10[1-(-1)],解得x=3,故答案为:3;
(2)往Na2S和Na2S2O3混合溶液中加入稀硫酸,Na2S和硫酸反应可以得到硫化氢气体,Na2S2O3溶液中加入稀硫酸,可以得到硫单质和二氧化硫气体,硫离子和硫代硫酸根离子之间反应,可以得到硫单质,故答案为:有淡黄色沉淀生成;可能产生臭鸡蛋气味的气体,也可能产生刺激性气味的气体;
(3)根据反应氧化还原反应:2H2O+SO2+2Na2S=S↓+4NaOH,当二氧化硫的量过量时,则不会出现硫化氢的气体,所以a:b≥1:2,故答案为:≥1:2.
点评 本题考查学生氧化还原反应的有关计算知识,注意知识的迁移应用是关键,难度中等.

(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
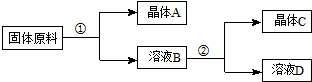
以下说法错误的是( )
| A. | ①和②的实验过程中,都需要控制温度 | |
| B. | ①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| C. | ②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| D. | 用95%的酒精洗涤所得的硝酸钾晶体比较好 |
| A. | 浓硝酸 | B. | 氢氟酸 | C. | 氢氧化钠溶液 | D. | 硝酸银固体 |
| A. | N2、HCl | B. | NH4Cl、H2 | C. | N2、NH4Cl | D. | N2、HCl、NH4Cl |
| A. | 煤焦油干馏可得到苯、甲苯等 | |
| B. | 煤裂化可得到汽油、柴油、煤油等轻质油 | |
| C. | 石油分馏可得到乙烯、丙烯等重要化工产品 | |
| D. | 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物 |
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |