题目内容
19.某元素一价阴离子的核外有18个电子,质量数为35,该微粒符号可表示为3517Cl-.分析 根据阴离子中核内质子数=核外电子数-电荷数,中子数=质量数-质子数以及原子符号的含义来解答.
解答 解:阴离子中核内质子数=核外电子数-电荷数=18-1=17,中子数=质量数-质子数=35-17=18,所以该微粒符号可表示为3517Cl-;
故答案为:3517Cl-.
点评 本题考查了离子中电子数、质子数、中子数和质量数之间的关系,难度不大,明确阳离子中核内质子数=核外电子数+电荷数,阴离子中核内质子数=核外电子数-电荷数.

练习册系列答案
相关题目
7.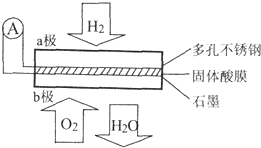 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | H+由b极通过固体酸电解质传递到a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4 mol电子,生成3.6g水 | |
| D. | 电池工作时,化学能主要转化为电能 |
11.在体积为V L的密闭容器中通入a mol NO和b mol O2,发生如下反应:2NO+O2═2NO2,反应后容器内氮原子和氧原子数之比是( )
| A. | a:b | B. | a:2b | C. | a:(2a+2b) | D. | a:(a+2b) |
8.下列相关关系正确的是( )
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
9.对于常温下浓度为0.01mol/L的醋酸溶液,以下说法不正确的是( )
| A. | 由水电离出来的c(H+)=1.0×10-12 mol/L | |
| B. | c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) | |
| D. | 在醋酸溶液中加入少量醋酸钠固体,能抑制醋酸的电离 |
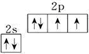 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位. .
.
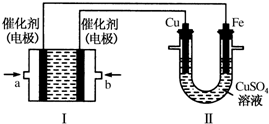
 .
.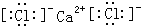 .
.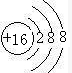 ;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.
;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.