题目内容
9.对于常温下浓度为0.01mol/L的醋酸溶液,以下说法不正确的是( )| A. | 由水电离出来的c(H+)=1.0×10-12 mol/L | |
| B. | c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) | |
| D. | 在醋酸溶液中加入少量醋酸钠固体,能抑制醋酸的电离 |
分析 A.醋酸为弱电解质,不能完全电离;
B.醋酸部分电离,且溶液中存在水的电离;
C.盐酸完全电离,稀释等体积时,盐酸溶液中氢离子浓度较大;
D.在醋酸溶液中加入少量醋酸钠固体,醋酸根离子浓度增大,电离平衡左移.
解答 解:A.醋酸为弱电解质,不能完全电离,则0.01mo1/L的醋酸溶液中,醋酸电离的氢离子浓度小于0.01mol/L,则由水电离出来的c(H+)>1.0×10-12mo1/L,故A错误;
B.醋酸部分电离,且电离程度较小,则c(CH3COOH)>c(H+),因溶液中存在水的电离,则c(H+)>c(CH3COO-)>c(OH-),故B正确;
C.盐酸完全电离,稀释等体积时,盐酸溶液中氢离子浓度较大,pH(醋酸)>pH(盐酸),故C正确;
D.在醋酸溶液中加入少量醋酸钠固体,醋酸根离子浓度增大,电离平衡左移,CH3COOH?CH3COO-+H+,电离程度减小,抑制醋酸的电离,故D正确.
故选A.
点评 本题考查了弱电解质的电离平衡、溶液pH计算、溶液中离子浓度大小比较,题目难度中等,解题的关键是理解电离平衡微弱,影响电离平衡的因素应用.

练习册系列答案
相关题目
4.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | NaCl溶于水 | D. | HCl气体溶于水 |
14.实验室中用CuSO4•5H2O来配制100mL 0.1mol/L CuSO4溶液,需要称量CuSO4•5H2O的质量为( )
| A. | 1.6 g | B. | 2.0 g | C. | 0.01 mol | D. | 2.5 g |
1.已知空气-锌电池的电极反应为:锌片,Zn+2OH--2e-═ZnO+H2O;碳棒,$\frac{1}{2}$O2+H2O+2e-═2OH-.据此判断,以下说法正确的是( )
| A. | Zn片作正极,Zn被还原 | B. | Zn片作负极,Zn被氧化 | ||
| C. | 碳棒作正极,O2被还原 | D. | 碳棒作负极,O2被氧化 |
18.下列物质在常温常压下为液体的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 葡萄糖 |
19.下列物质中,含有共价键的离子化合物是( )
| A. | N2 | B. | NaOH | C. | HCl | D. | NaCl |
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 .
. ,合成路线流程图为:
,合成路线流程图为: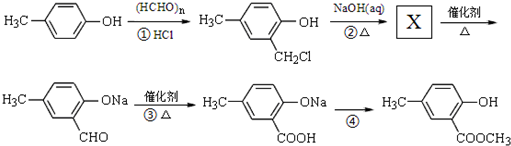
 ;
; 任意一种.
任意一种.