题目内容
8.下列相关关系正确的是( )| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
分析 A.非金属性越强,氢化物越稳定;
B.同周期原子序数大的原子半径小;电子层越多,原子半径越大;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.具有相同电子排布的离子,原子序数大的离子半径小.
解答 解:A.非金属性越强,氢化物越稳定,则热稳定性:HF>H2O>H2S,故A错误;
B.同周期原子序数大的原子半径小;电子层越多,原子半径越大,则原子半径为Na>Mg>O,故B正确;
C.非金属性越强,对应最高价氧化物的水化物酸性越强,则酸性为H3PO4<H2SO4<HClO4,故C错误;
D.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->Cl->K+,故D错误;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
18.用如所示装置除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,下列说法正确的是( )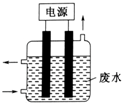

| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
16.中国和瑞典的科学家共同发现了治疗非典的新方法:吸入一氧化氮可快速改善重症非典患者的缺氧状况,缓解病情.病毒学研究同时证实,一氧化氮对非典病毒有直接抑制作用.下列有关NO的说法不正确的是( )
| A. | NO任意排放会造成大气污染 | |
| B. | 汽车尾气、制硝酸工厂的废气均含NO | |
| C. | NO是造成光化学烟雾的唯一直接原因 | |
| D. | NO分子所含电子总数为奇数 |
3.下列有关化学用语表述正确的是( )
| A. | 醛基的结构简式-CHO | B. | 聚丙烯的结构简式 | ||
| C. | 乙醇的结构简式C2H6O | D. | 四氯化碳的电子式 |
13.提出原子核式结构模型的科学家是( )
| A. | 汤姆生 | B. | 玻尔 | C. | 卢瑟福 | D. | 查德成克 |
18.下列物质在常温常压下为液体的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 葡萄糖 |
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 .
. ,合成路线流程图为:
,合成路线流程图为: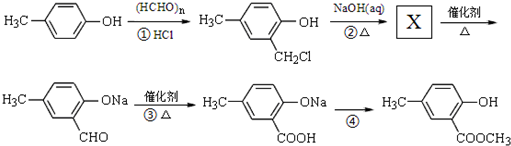
 ;
; 任意一种.
任意一种.