题目内容
下列推断合理的是( )
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、浓H2SO4有强氧化性,但不能与Cu发生反应 |
| D、SO2具有还原性,故可作漂白剂 |
考点:盐类水解的应用,二氧化硫的化学性质,浓硫酸的性质,钠的化学性质
专题:元素及其化合物
分析:A、明矾[KAl(SO4)2?12H2O]在水中水解能形成Al(OH)3胶体,可用作净水剂;
B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应,首先钠与水反应生成氢氧化钠与氯化镁反应生成氢氧化镁;
C、浓H2SO4有强氧化性,在加热的条件下能与Cu发生反应,生成二氧化硫;
D、SO2具有还原性,故可作还原剂,而不是漂白的原理.
B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应,首先钠与水反应生成氢氧化钠与氯化镁反应生成氢氧化镁;
C、浓H2SO4有强氧化性,在加热的条件下能与Cu发生反应,生成二氧化硫;
D、SO2具有还原性,故可作还原剂,而不是漂白的原理.
解答:
解:A、明矾[KAl(SO4)2?12H2O]在水中水解能形成Al(OH)3胶体,可用作净水剂,故A正确;
B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应,首先钠与水反应生成氢氧化钠与氯化镁反应生成氢氧化镁,不发生置换反应,故B错误;
C、浓H2SO4有强氧化性,在加热的条件下能与Cu发生反应,生成二氧化硫,不是不反应,故C错误;
D、SO2具有还原性,故可作还原剂,而不是漂白的原理,漂白是非氧化还反应,故D错误;故选A.
B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应,首先钠与水反应生成氢氧化钠与氯化镁反应生成氢氧化镁,不发生置换反应,故B错误;
C、浓H2SO4有强氧化性,在加热的条件下能与Cu发生反应,生成二氧化硫,不是不反应,故C错误;
D、SO2具有还原性,故可作还原剂,而不是漂白的原理,漂白是非氧化还反应,故D错误;故选A.
点评:本题考查物质的性质,综合考查元素化合物性质,为高频考点,把握二氧化硫、钠、浓硫酸等物质的性质为解答的关键,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
向盛有10mL AlCl3溶液试管,逐渐滴入加NaOH溶液的图象如图,则下列说法不正确的是( )
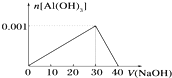

| A、AlCl3溶液的浓度为0.1mol?L-1 |
| B、NaOH溶液的浓度为0.1mol?L-1 |
| C、沉淀最大质量为0.078g |
| D、加入10mL的NaOH溶液与加入38mL的NaOH溶液产生的沉淀质量相同 |
含一个叁键的炔烃,氢化后的产物的结构简式CH3CH2CH(CH2CH3)CH2CH(CH3)CH2CH3此炔烃可能的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
下列说法中不正确的是( )
| A、Na2O2可做呼吸面具的供氧剂 |
| B、单质硅是生产光导纤维的基本原料 |
| C、目前世界上使用量最大的合金是钢 |
| D、明矾可作净水剂 |
下列事实不能用化学平衡移动原理解释的是( )
| A、合成氨工业中采用高压条件 |
| B、由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C、用排饱和食盐水的方法收集Cl2 |
| D、反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
以下物质之间能反应的是( )
| A、氧化镁与铝单质 |
| B、四氧化三铁与铝单质 |
| C、铜单质与稀硫酸 |
| D、二氧化硅与水 |