题目内容
2.其化学课外兴趣小组要提纯含CaCl2、Na2SO4及泥沙等杂质的粗盐,将粗盐溶于适量水中,再按以下流程进行处理: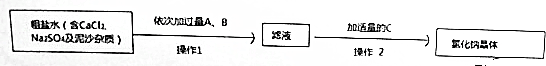
(1)从稀盐酸、Na2SO3、Ba(OH)2、Na2CO3、Ba(NO3)2溶液中选择试剂:ABa(OH)2,BNa2CO3,C稀盐酸.
(2)操作1和操作2的名称分别是过滤、蒸发结晶.
(3)写出加过量A、B时发生的化学反应方程式Ba(OH)2+Na2SO4=BaSO4↓+2NaOH,Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,CaCl2+Na2CO3=CaCO3↓+2NaCl.
(4)控制加适量C的方法是用PH试纸测试溶液的pH呈中性.
分析 (1)加过量的Ba(OH)2除去SO42-,加过量Na2CO3除去Ca2+和过量的Ba2+,加盐酸除去OH- 和CO32-,使溶液的溶质为NaCl;
(2)过滤除去CaCO3、BaSO4、BaCO3 沉淀,对氯化钠溶液进行蒸发浓缩、冷却结晶制得氯化钠晶体;
(3)过量的Ba(OH)2、Na2CO3淀是为了除去Ca2+、SO42- Ba2+杂质离子,方程式见答案;
(4)加稀盐酸是调节溶液pH,除去OH- 和CO32-,最终溶液为氯化钠溶液,呈中性,故可以用pH试纸测溶液pH接近7.
解答 解:(1)加过量的Ba(OH)2除去SO42-,加过量Na2CO3除去Ca2+和过量的Ba2+,加盐酸除去OH- 和CO32-,使溶液的溶质为NaCl,故答案为:Ba(OH)2、Na2CO3、稀盐酸;
(2)过滤除去CaCO3、BaSO4、BaCO3 沉淀,对氯化钠溶液进行蒸发浓缩、冷却结晶制得氯化钠晶体,故答案为:过滤、蒸发结晶;
(3)过量的Ba(OH)2、Na2CO3淀是为了除去Ca2+、SO42- Ba2+杂质离子,故答案为:Ba(OH)2+Na2SO4=BaSO4↓+2NaOH,Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,CaCl2+Na2CO3=CaCO3↓+2NaCl;
(4)加稀盐酸是调节溶液pH,除去OH- 和CO32-,最终溶液为氯化钠溶液,呈中性,故可以用pH试纸测溶液pH接近7,故答案为:用PH试纸测试溶液的pH呈中性.
点评 本题考查学生对粗盐提纯的基本方法,掌握分离提纯我的基本方法和操作,属于中等难度试题.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
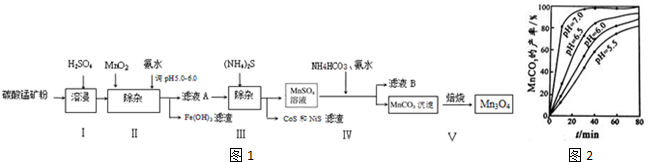
4.高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.图是用高炉烟尘制取硫酸锌的工业流程.

已知:
①20℃时,0.1mol•L-1的金属离子沉淀时的pH
②过二硫酸铵是一种强氧化剂.
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(5)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A、锌粉 B、氨水 C、(NH4)2CO3 D、NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.

已知:
①20℃时,0.1mol•L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(5)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A、锌粉 B、氨水 C、(NH4)2CO3 D、NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.
1.某化学兴趣小组设计了下列实验,后记录如下:
下列说法中不正确的是( )
| 步 骤 | 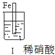 | 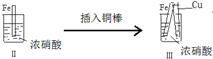 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
12.下列有水参加的反应中,不属于盐类水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
 ;
;

