题目内容
8.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.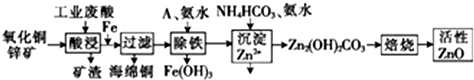
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.7 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气搅拌外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<(填“>”“<”或“=”)Ksp(ZnS).
(3)物质A最好使用下列物质中的B.
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(5)物质B是可直接用作氮肥的正盐,则B的化学式是(NH4)2SO4.
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
分析 氧化铜锌矿经废酸浸取后过滤,可得到硫酸铜、硫酸锌溶液;向酸浸液中加铁可还原出铜,经过滤可得铜和硫酸亚铁、硫酸锌的混合液;然后加入A和氨水,将亚铁转化为氢氧化铁沉淀而除去;后向滤液中加氨水等将锌离子转化为Zn2(OH)2CO3,最后焙烧,Zn2(OH)2CO3受热分解得到氧化锌,
(1)影响化学反应速率的因素有:温度、浓度、固体表面积等;
(2)相同条件下,溶解度大的物质先溶解;
(3)所用试剂能除去杂质,但不能引入新的杂质;
(4)PH的范围应使铁完全沉淀而锌不沉淀;
(5)结合题给信息利用工业废酸和氮肥考虑;
(6)从题给信息写出反应物和生成物,配平即可.
解答 解:(1)影响化学反应速率的因素有多种,要提高氧化铜锌矿的酸浸速率,可采取的措施还有升高温度(增大酸浓度、将氧化铜锌矿粉碎--增大表面积等),
故答案为:适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等);
(2)相同条件下,溶解度大的物质先溶解;因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),
故答案为:<;
(3)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,且考虑加入A不引入新的杂质.除空气外,其他试剂均可引入新的杂质,
故答案为:B;
(4)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2.故除铁PH范围为:3.2~6.2,
故答案为:3.2~6.2;
(5)因所用废酸为硫酸,B又可作氮肥,所以B为(NH4)2SO4,
故答案为:(NH4)2SO4;
(6)由题给信息可知,反应物为2Fe(OH)3、ClO-、OH-,生成物之一为FeO42-,因铁在反应中化合价升高,故氯元素的化合价降低,则另一产物为Cl-,根据元素、电子、电荷守恒配平(可知产物还有水),则方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
点评 本题属于化学工艺流程方面的题目.要搞清实验目的和题给信息,结合流程和题目设问正确解题,综合性较强.

| A. | NaCl晶体与冰 | B. | 石英与干冰 | C. | 金刚石与KCl晶体 | D. | 冰与干冰 |
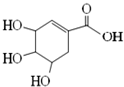
| A. | 分子式为C7H8O5 | |
| B. | 分子中含有2种官能团,可发生加成、酯化反应 | |
| C. | 其同分异构体中可能含酯基和醛基,不可能含有苯环 | |
| D. | 该化合物与足量的 Na、NaOH反应得到的钠盐产物相同 |
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些染料褪色 | ||
| C. | 二氧化硫使品红溶液褪色 | D. | 活性炭使红墨水褪色 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.

 .
. ;
; .
. X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1.
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1. ;W元素的名称为镍.
;W元素的名称为镍.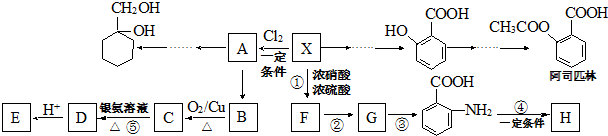
 (苯胺,易被氧化)
(苯胺,易被氧化)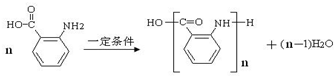 .
.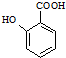 的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.
的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种. 和其他无机物合成
和其他无机物合成 最合理的方案.
最合理的方案. .
. ;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)
;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)