题目内容
18.为测定所使用锡粉的纯度,取质量为m的锡粉溶液稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c的K2Cr2O7的标准液滴定生成的Fe2+(酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为V.则锡粉中锡的质量分数是$\frac{3cVM}{M}$(Sn的摩尔质量为M,用含m、c、V、M的代数式表示).分析 用已知浓度的K2Cr2O7滴定生成的Fe2+,根据原子守恒、电子转移守恒可得关系式:Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,据此计算.
解答 解:令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7
M g $\frac{1}{3}$mol
mx g cV mol
故 M g:mx g=$\frac{1}{3}$mol:cV mol
解得x=$\frac{3cVM}{M}$,
故答案为:$\frac{3cVM}{M}$.
点评 本题考查氧化还原反应滴定计算,涉及的化学反应比较多,计算过程也很复杂,为易错题目,注意利用关系式进行计算解答,题目难度中等.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
9.下列物质既是电解质又能导电的是( )
| A. | NaCl晶体 | B. | 液态HCl | C. | 熔融的KNO3 | D. | Na2SO4溶液 |
6.某溶液既能溶解A12O3,又能H2SiO3,在该溶液中可以大量共存的离子是( )
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
13.下列溶液中,跟150mL0.5mol/LNaCl溶液所含的氯离子物质的量浓度相同的是( )
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
5.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
9.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3ˉ、NO3ˉ、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
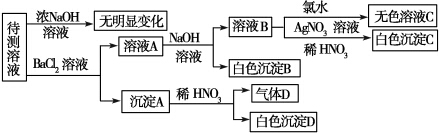
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
(2)待测溶液中是否有SO42-、SO32-中的一种或两种.若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,形成沉淀B时反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O.
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.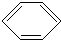 +Cl2
+Cl2
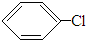 +HCl,反应类型取代反应.
+HCl,反应类型取代反应.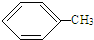 +3HO-NO2
+3HO-NO2
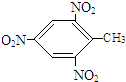 +3H2O,反应类型取代反应.
+3H2O,反应类型取代反应. +3H2
+3H2
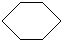 ,反应类型加成反应.
,反应类型加成反应. +Br2
+Br2
 +HBr,反应类型取代.
+HBr,反应类型取代.