题目内容
取一定量FeO和Fe2O3的混合物,在H2流中加热充分反应.冷却,称得剩余固体比原混合物质量减少1.200g,若将同量的该混合物与盐酸反应完全,至少需1mol/L盐酸的体积为( )
| A、37.5mL |
| B、75mL |
| C、150mL |
| D、300mL |
考点:有关混合物反应的计算
专题:分析比较法
分析:FeO和Fe2O3的混合物,在H2流中加热充分反应后,生成Fe与H2O,剩余固体比原混合物质量减少1.200g为混合物中O元素质量;若将同质量的混合物与盐酸反应,欲使之完全溶解,混合物中O元素与HCl中H元素结合生成H2O,则n(H2O)=n(O),由H原子守恒n(HCl)=2n(H2O),进而计算盐酸的体积.
解答:
解:FeO和Fe2O3的混合物,在H2流中加热充分反应后,生成Fe与H2O,剩余固体比原混合物质量减少1.200g为混合物中O元素质量,
若将同质量的混合物与盐酸反应,欲使之完全溶解,混合物中O元素与HCl中H元素结合生成H2O,
则:n(H2O)=n(O)=
=0.075mol,
由H原子守恒可得:n(HCl)=2n(H2O)=0.075mol×2=0.15mol,
所以需要1mol/L盐酸的体积为:
=0.15L=150mL,
故选C.
若将同质量的混合物与盐酸反应,欲使之完全溶解,混合物中O元素与HCl中H元素结合生成H2O,
则:n(H2O)=n(O)=
| 1.200g |
| 16g/mol |
由H原子守恒可得:n(HCl)=2n(H2O)=0.075mol×2=0.15mol,
所以需要1mol/L盐酸的体积为:
| 0.15mol |
| 1mol/L |
故选C.
点评:本题考查了混合物反应的计算,题目难度中等,明确反应实质为解答关键,注意质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
化学概念在逻辑上存在如图所示的三种关系,下列说法错误的是( )
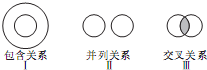

| A、烃与烷烃属于I |
| B、电解质与非电解质属于Ⅱ |
| C、离子反应与氧化还原反应属于Ⅲ |
| D、酸性氧化物与非金属氧化物属于I |
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA(相对原子质量 Cu:64) |
| C、1L 1.0mol?L-1NH4Cl与2L 0.5mol?L-1NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.1NA |
镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池.氢镍电池的总反应式是:
H2+NiO(OH)=Ni(OH)2据此反应式判断,下列叙述中正确的是( )
| 1 |
| 2 |
| A、电池放电时,电池负极周围的溶液pH不断增大 |
| B、电池放电时,镍元素被氧化 |
| C、电池放电时,镍元素被还原 |
| D、电池放电时,H2是负极 |