题目内容
4.化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是( )| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 制作Fe(OH)3胶体时,应将蒸馏水与FeCl3溶液混合加热,煮沸至液体呈红褐色 | |
| C. | 各放一张质量相同的滤纸于天平两托盘上,将Na2CO3固体放在右盘纸上称量 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
分析 A.胶头滴管不能紧贴试管内壁,防止污染;
B.应该将饱和氯化铁溶液滴入沸水中,然后进行加热;
C.称量Na2CO3固体时,需要垫上滤纸,防止腐蚀托盘;
D.稀释浓硫酸时不能用量筒,应该在烧杯中稀释.
解答 解:A.向试管中滴加液体时,胶头滴管应垂直悬空,不能紧贴试管内壁,避免污染试剂,故A错误;
B.制作Fe(OH)3胶体的正确方法为:向沸水中滴入几滴饱和FeCl3溶液,继续加热煮沸至溶液呈红褐色,故B错误;
C.碳酸钠具有腐蚀性,称量时各放一张质量相同的滤纸于天平两托盘上,然后将Na2CO3固体放在右盘纸上称量,故C正确;
D.配制H2SO4溶液时,先在烧杯中加一定体积的水,再在搅拌下慢慢加入浓硫酸,不能使用量筒稀释,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及氢氧化铁胶体制备、浓硫酸稀释、常见仪器的使用方法等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知反应mX(g)+nY(g)?qZ(g)△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是( )
| A. | 通入稀有气体使压强增大,平衡不移动 | |
| B. | 增大压强同时又升高温度,反应速率加快且可以提高Z 的产率 | |
| C. | 降低温度,混合气体的平均相对分子质量变大 | |
| D. | 增加X的物质的量,Y的转化率增大 |
12.下列各组物质中,可按溶解、过滤、蒸发结晶的操作顺序分离的是( )
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA | |
| C. | 78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA | |
| D. | 标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA |
9.关于1mol/L K2SO4溶液的下列说法正确的是( )
| A. | 溶液中含有1mol K2SO4 | B. | 1molK2SO4溶于1L水中 | ||
| C. | 溶液中c(K+ )=2mol/L | D. | 1L 溶液中含2molK+,4mol O2- |
16.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10mL刻度处,现把管内液体全部流下排出,用量筒接收,所得溶液的体积( )
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
13.已烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是( )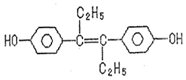

| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
8.在2L密闭容器内,充入0.2mol NO气体和0.1molO2,T℃时下列反应:
2NO(g)+O2(g)═2NO2(g)体系中n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.该温度下反应的平衡常数K=$\frac{900}{8}$.
已知:K300℃>K350℃,则该反应是放热反应.
(2)达到平衡时v(NO)为2×10-2 mol/(L•s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内气体的密度保持不变
e.容器内气体的颜色不再变化
(4)达到平衡时若移走部分NO2,则下列说法正确的是bc.
a.平衡将向正向移动,正反应速率增大,逆反应速率减小
b.重新到达平衡时,NO的平衡转化率将增大,平衡常数不变
c.重新到达平衡时,容器内混合气体的密度较原来减小,压强也减小.
2NO(g)+O2(g)═2NO2(g)体系中n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.09 | 0.08 | 0.08 | 0.08 |
已知:K300℃>K350℃,则该反应是放热反应.
(2)达到平衡时v(NO)为2×10-2 mol/(L•s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内气体的密度保持不变
e.容器内气体的颜色不再变化
(4)达到平衡时若移走部分NO2,则下列说法正确的是bc.
a.平衡将向正向移动,正反应速率增大,逆反应速率减小
b.重新到达平衡时,NO的平衡转化率将增大,平衡常数不变
c.重新到达平衡时,容器内混合气体的密度较原来减小,压强也减小.