题目内容
13.已知一定条件下体积不变的密闭容器中(各物质均为气态),1mol N2和3mol H2充分反应生成 NH3放热为Q1 kJ,下列说法正确的是( )| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
分析 A.该反应为可逆反应,则反应生成的氨气小于2mol,该生成2mol氨气放出的热量大于Q1kJ;
B.放热反应中,反应物总能量大于生成物总能量;
C.相同条件下将2molN2和6molH2置于相同容器中,增大了压强,平衡向着正向移动,则放出的热量大于2Q1;
D.该反应前后都是气体,容器的容积不变,则混合气体的密度始终不变.
解答 解:A.1mol N2和3mol H2充分反应生成NH3放热为Q1kJ,应用该反应为可逆反应,则平衡时生成氨气的物质的量小于2mol,所以生成2mol氨气放出的热量大于Q1kJ,
上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H<-Q1 kJ/mol,故A错误;
B.该反应为放热反应,则相同条件下1mol N2(g)和3mol H2(g)的总键能小于2molNH3(g)的总键能,故B正确;
C.相同条件下将2molN2和6molH2置于相同容器中,增大了压强,平衡向着正向移动,生成氨气的物质的量增大,则放出的热量Q2>2Q1,故C错误;
D.反应N2(g)+3H2(g)═2NH3(g)的反应物、生成物都是气体,且容器的容积不变,根据ρ=$\frac{m}{V}$可知,混合气体的密度始终不变,不能根据密度判断平衡状态,故D错误;
故选B.
点评 本题考查较为综合,涉及反应热与焓变、可逆反应特点、平衡状态判断等知识,题目难度中等,明确化学反应与能力变化的关系为解答关键,注意掌握化学平衡及其影响,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.某油脂X可由甘油(丙三醇:C3H8O3)和油酸(C18H34O2)脱水形成.已知1mol甘油和3mol油酸反应得到1molX,X的分子式是( )
| A. | C57H104O6 | B. | C57H108O6 | C. | C57H106O6 | D. | C57H102O6 |
19.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | X、Z、W均可形成两种常见氧化物 | |
| B. | 四种元素在自然界均不能以游离态存在 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
1.某化学学习小组的同学对放置已久的过氧化钠的成分进行探究,请回答下列问题:
(1)反应2Na2O2+2H2O═4NaOH+O2↑的还原剂是Na2O2(写化学式);反应2Na2O2+2CO2═2Na2CO3+O2的氧化剂是Na2O2(写化学式),每生成1mol O2转移2mol电子.
(2)进行探究:
①提出假设.
假设1:全部是Na2O2
假设2:全部是Na2CO3
假设3:是Na2O2与Na2CO3的混合物.
②设计方案,进行实验.请写出实验步骤以及预期的现象和结论(可不填满).限选实验试剂和仪器:蒸馏水、1mol•L-1 H2SO4溶液、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯、胶头滴管.
(1)反应2Na2O2+2H2O═4NaOH+O2↑的还原剂是Na2O2(写化学式);反应2Na2O2+2CO2═2Na2CO3+O2的氧化剂是Na2O2(写化学式),每生成1mol O2转移2mol电子.
(2)进行探究:
①提出假设.
假设1:全部是Na2O2
假设2:全部是Na2CO3
假设3:是Na2O2与Na2CO3的混合物.
②设计方案,进行实验.请写出实验步骤以及预期的现象和结论(可不填满).限选实验试剂和仪器:蒸馏水、1mol•L-1 H2SO4溶液、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,滴加足量1mol•L-1 H2SO4溶液,然后将内壁附有澄清石灰水的烧杯罩于试管口 | 若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立 或假设1不成立. |
| 步骤2: | |
| 步骤3: |
8.化合物X的分子式为C5H11Cl,用NaOH醇溶液处理X,可得到分子式为C5H10的两种产物Y、Z;Y、Z经催化加氢都可得到2-甲基丁烷.则X的结构简式为( )
| A. | CH3CH2CH2CH2CH2Cl | B. | CH3CH2CHClCH2CH3 | ||
| C. |  | D. |  |
5.表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
(1)⑦为O(填元素符号);
(2)①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是NaOH (填化学式);
(3)②、③、④三种元素可形成的离子,离子半径由大到小的顺序为K+>Ca2+>Mg2+(请填离子符号);
(4)①和⑨两元素形成化合物灼烧时的焰色为黄 色;该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是NaOH (填化学式);
(3)②、③、④三种元素可形成的离子,离子半径由大到小的顺序为K+>Ca2+>Mg2+(请填离子符号);
(4)①和⑨两元素形成化合物灼烧时的焰色为黄 色;该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
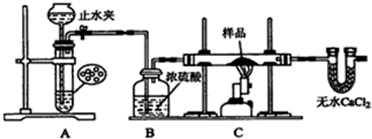
 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.