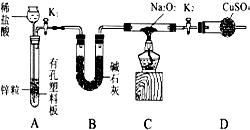
题目内容
19.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )| A. | X、Z、W均可形成两种常见氧化物 | |
| B. | 四种元素在自然界均不能以游离态存在 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
分析 X元素的原子的最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,L为最外层电子数为4,则X是C元素;Y是非金属性最强的元素,则Y为F元素;Z原子半径在同周期元素中最大,其原子序数大于C、F元素,则Z为Na;W可与Z形成离子化合物Z2W,即Na2W,W为-2价,原子序数大于Na,则W为S元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:X元素的原子的最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,L为最外层电子数为4,则X是C元素;Y是非金属性最强的元素,则Y为F元素;Z原子半径在同周期元素中最大,其原子序数大于C、F元素,则Z为Na;W可与Z形成离子化合物Z2W,即Na2W,W为-2价,原子序数大于Na,则W为S元素,
A.C、Na、S分别可形成CO和二氧化碳、氧化钠和过氧化钠、二氧化硫和三氧化硫,故A正确;
B.Na、F在自然界中以化合态存在,但C和S在自然界中存在游离态,故B错误;
C.Y为F元素,位于ⅤⅡA族,F的最高化合价为0,不是+7,故C错误;
D.离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则离子半径:W>Y>Z,故D错误;
故选:A.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.下列溶液中有关物质的浓度关系正确的是( )
| A. | Na2C2O4溶液中,2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比前者大 | |
| D. | 0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
7.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
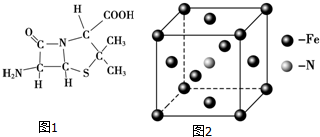
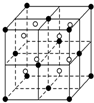
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(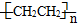 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$g•cm-3.
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
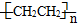 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:
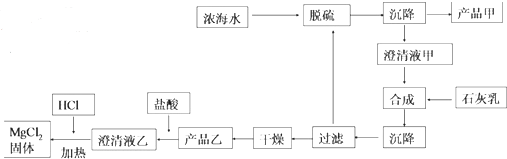
浓海水的主要成分如表:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
13.已知一定条件下体积不变的密闭容器中(各物质均为气态),1mol N2和3mol H2充分反应生成 NH3放热为Q1 kJ,下列说法正确的是( )
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
14.下列说法正确的是( )
| A. | 煤经气化或液化这两个化学变化过程都可以转变为清洁能源 | |
| B. | 石油裂解目的是提高汽油的质量和产量 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.