题目内容
8.化合物X的分子式为C5H11Cl,用NaOH醇溶液处理X,可得到分子式为C5H10的两种产物Y、Z;Y、Z经催化加氢都可得到2-甲基丁烷.则X的结构简式为( )| A. | CH3CH2CH2CH2CH2Cl | B. | CH3CH2CHClCH2CH3 | ||
| C. | 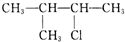 | D. | 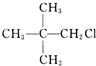 |
分析 根据能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为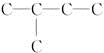 .氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,以此解答该题.
.氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基,以此解答该题.
解答 解:根据能跟H2加成生成2-甲基丁烷,说明Y和Z均为分子中含5个C原子的不饱和烃,其碳骨架为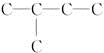 ,氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基.
,氯代烃发生消去反应生成烯烃和烯烃加氢生成烷烃,碳架不变,故化合物X的碳架有一个支链甲基.
A.CH3CH2CH2CH2Cl没有支链,故A错误;
B.(CH3)2CHCH2CH2Cl发生消去反应只生成一种烯烃,故B错误;
C.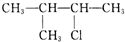 含有一个支链甲基,发生消去反应生成两种烯烃:(CH3)2C=CHCH3;CH2=C(CH3)CH2(CH3),故C正确;
含有一个支链甲基,发生消去反应生成两种烯烃:(CH3)2C=CHCH3;CH2=C(CH3)CH2(CH3),故C正确;
D. 有两个支链,故D错误;
有两个支链,故D错误;
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,熟悉卤代烃消去的规律和烯烃的加成特点是解题的关键,难度不大.

练习册系列答案
相关题目
13.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
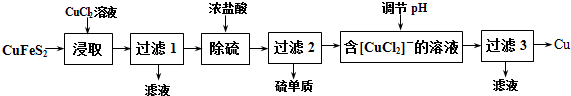
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:
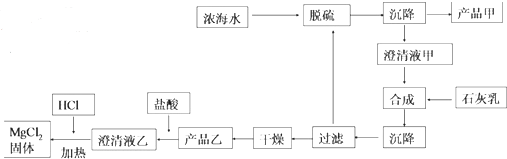
浓海水的主要成分如表:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
13.已知一定条件下体积不变的密闭容器中(各物质均为气态),1mol N2和3mol H2充分反应生成 NH3放热为Q1 kJ,下列说法正确的是( )
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
17.在溶液中能大量共存的离子组是( )
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.