题目内容
2.某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究.查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+═Cu+Cu2++H2O探究一:用如图所示装置进行实验,回答下列问题:
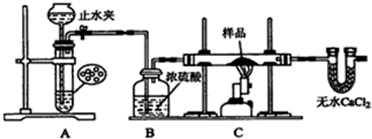
(1)仪器组装完成后,夹好止水夹,向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变,则说明装置A的气密性良好.
(2)从下列实验步骤中,选择正确的操作顺序:①⑥⑤④②③(填序号)
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯 ⑥通入气体一段时间,排尽装置内的空气
(3)收集氢气验纯时,最好采用排水方法收集氢气.
探究二:
(4)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确否(填“是”或“否”)若填“否”,则原因是2Fe3++Cu=2 Fe2++Cu2+(结合离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有Cu2O,取少量反应后的溶液,加适量蒸馏水稀释后,滴加KSCN溶液(填试剂)若溶液变血红色(实验现象),则可证明另一成分存在,反之,说明样品中不含该成分.
探究三:
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=0.55mol.
分析 根据图象知,A装置实验目的是制取还原性气体,用的是简易启普发生器制取气体,可以用稀硫酸和Zn制取氢气;B装置作用是干燥气体,C装置用氢气还原红色物质,用无水氯化钙吸收水分;
探究一:
(1)利用压强差检验装置气密性;
(2)打开止水夹生成氢气,通过后续装置充满氢气排出装置中的空气后,检验气体纯度,收集检验氢气纯度,气体纯净后点燃C处的酒精喷灯,反应完成熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化;
(3)氢气不易溶于水,且密度小于空气,可以采用排水法或排空气法收集氢气,但排水法收集氢气较纯净;
探究二:
(4)氧化铁能溶于稀硫酸生成铁离子,铁离子能氧化铜生成铜离子;
铜和浓硝酸反应生成红棕色气体NO2;Fe3+用KSCN溶液检验,二者混合溶液呈血红色;
探究三:
(5)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,结合化学方程式定量关系计算得到.
解答 解:根据图象知,A装置实验目的是制取还原性气体,用的是简易启普发生器制取气体,可以用稀硫酸和Zn制取氢气;B装置作用是干燥气体,C装置用氢气还原红色物质,用无水氯化钙吸收水分;
(1)利用压强差检验装置气密性,其检验方法为:向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变,则该装置气密性良好,
故答案为:向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变;
(2)氢气混有空气加热发生爆炸,所以开始先通氢气,打开止水夹生成氢气,通过后续装置充满氢气,目的是排出装置中的空气,检验最后U型管出来的气体氢气纯度,气体纯净后再点燃C处的酒精喷灯,反应完成后先撤酒精灯,玻璃管冷却再停氢气,操作位熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化,所以其排列顺序是①⑥⑤④②③;
故答案为:①⑥⑤④②③;
(3)氢气不易溶于水,且密度小于空气,可以采用排水法或排空气法收集氢气,但排水法收集氢气较纯净,故答案为:排水;
(4)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O,此观点不正确,原因是生成的铜和铁离子发生氧化还原反应,离子方程式为2Fe3++Cu=2Fe2++Cu2+;
另取少量样品于试管中,加入适量的浓硝酸,Cu和浓硝酸发生氧化还原反应生成红棕色气体二氧化氮,所以看到的现象是产生红棕色气体,证明样品中一定含有Cu2O;
反应后的溶液中含有Fe2+、Cu2+,可能含有Fe3+,取少量反应后的溶液,加适量蒸馏水稀释后,滴加KSCN溶液,铁离子和KSCN溶液混合产生血红色,滴加KSCN溶液后溶液呈血红色,则可证明另一成分存在,反之,说明样品中不含该成分,
故答案为:否;2Fe3++Cu=2 Fe2++Cu2+;红棕色的气体;Cu2O;KSCN溶液;若溶液变血红色;
(5)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,生成1.0molFe2+,消耗Cu0.5mol,剩余Cu物质的量=$\frac{3.2g}{64g/mol}$=0.05mol,原样品中Cu2O物质的量=0.05mol+0.5mol=0.55mol,
故答案为:0.55.
点评 本题考查物质成分检验,为高频考点,涉及方程式的计算、离子检验、实验操作先后顺序等知识点,明确实验原理及物质性质、实验操作方法等知识点是解本题关键,注意离子检验操作方法、实验现象,题目难度中等.

 科学实验活动册系列答案
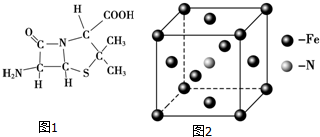
科学实验活动册系列答案(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
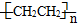 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
 ,其中B与E互为同分异构体,则A可能的结构有( )
,其中B与E互为同分异构体,则A可能的结构有( )| A. | 2种 | B. | 6种 | C. | 8种 | D. | 4种 |
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
| A. | 煤经气化或液化这两个化学变化过程都可以转变为清洁能源 | |
| B. | 石油裂解目的是提高汽油的质量和产量 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 乙烯和苯均能发生氧化反应,说明两者都有碳碳双键 |
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
| A. | F-H | B. | Cl-H | C. | Br-H | D. | I-H |
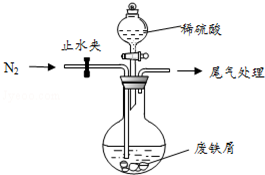 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: