题目内容
10.为探究含结晶水的化合物X(含四种元素,摩尔质量为180g•mol-1)的组成和性质,某兴趣小组设计并完成如下实验:
请回答:
(1)黑色固体Y的化学式为FeO,气体C的电子式为
 .
.(2)晶体X隔绝空气受热分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O↑.
分析 27.0gX隔绝空气加热分解生成H2O、黑色固体Y质量10.8g,加入盐酸溶解得到溶液中加入KSCN溶液无变化说明无铁离子,通入氯气溶液变红色说明元溶液含亚铁离子,则黑色固体为亚铁离子的化合物,分解得到的混合溶液通入足量澄清石灰生成白色沉淀A为碳酸钙,足量为15.0g,分解生成的二氧化碳物质的量为等于碳酸钙物质的量,物质的量n(CaCO3)=n(CO2)=$\frac{15.0g}{100g/mol}$=0.15mol,气体B通过足量CuO加热反应生成气体C,通过足量澄清石灰水生成白色沉淀A为碳酸钙,则混合气体中一氧化碳物质的量等于生成的碳酸钙物质的量,物质的量n(CaCO3)=n(CO)=$\frac{15.0g}{100g/mol}$=0.15mol,结晶水的化合物X(含四种元素,摩尔质量为180g•mol-1)其物质的量=$\frac{27g}{180g/mol}$=0.15mol,四种元素组成判断黑色固体Y为FeO,物质的量n(FeO)=$\frac{10.8g}{72g/mol}$=0.15mol,结晶水合物中含结晶水物质的量n(H2O)=$\frac{27.0g-10.8g-0.15mol×(28+44)g/mol}{18g/mol}$=0.3mol,1mol结晶水合物中含铁元素1mol碳元素2mol,结晶水物质的量2mol,设化学式为FeC2Ox•2H2O,摩尔质量为180g•mol-1 ,计算得到x=4,得到化学式为:FeC2O4•2H2O,
(1)分析可知黑色固体Y为氧化亚铁,CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,据此书写即可;
(2)计算分析得到产物物质的量和结晶水合物物质的量写出化学方程式;
解答 解:27.0gX隔绝空气加热分解生成H2O、黑色固体Y质量10.8g,加入盐酸溶解得到溶液中加入KSCN溶液无变化说明无铁离子,通入氯气溶液变红色说明元溶液含亚铁离子,则黑色固体为亚铁离子的化合物,分解得到的混合溶液通入足量澄清石灰生成白色沉淀A为碳酸钙,足量为15.0g,分解生成的二氧化碳物质的量为等于碳酸钙物质的量,物质的量n(CaCO3)=n(CO2)=$\frac{15.0g}{100g/mol}$=0.15mol,气体B通过足量CuO加热反应生成气体C,通过足量澄清石灰水生成白色沉淀A为碳酸钙,则混合气体中一氧化碳物质的量等于生成的碳酸钙物质的量,物质的量n(CaCO3)=n(CO)=$\frac{15.0g}{100g/mol}$=0.15mol,结晶水的化合物X(含四种元素,摩尔质量为180g•mol-1)其物质的量=$\frac{27g}{180g/mol}$=0.15mol,四种元素组成判断黑色固体Y为FeO,物质的量n(FeO)=$\frac{10.8g}{72g/mol}$=0.15mol,结晶水合物中含结晶水物质的量n(H2O)=$\frac{27.0g-10.8g-0.15mol×(28+44)g/mol}{18g/mol}$=0.3mol,1mol结晶水合物中含铁元素1mol碳元素2mol,结晶水物质的量2mol,设化学式为FeC2Ox•2H2O,摩尔质量为180g•mol-1 ,计算得到x=4,得到化学式为:FeC2O4•2H2O,
(1)分析可知黑色固体Y为FeO,CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为 ,
,
故答案为:FeO; ;
;
(2)分析可知1molFeC2O4•2H2O受热分解生成1molFeO、1molCO2、1molCO、2molH2O,化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O↑,
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O↑.
点评 本题综合考查无机物的推断,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握物质的性质以及反应现象,结合质量守恒推断物质的组成,难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 元素C的单质只存在金刚石和石墨两种同素异形体 | |
| D. | 该反应中化学能全部转化为热能 |
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液中OH-总数不变,有O2放出 | ||
| C. | 溶液的pH增大,有O2放出 | D. | 溶液中Na+总数减少,有O2放出 |
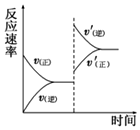 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n<p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n>p+q |
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A. | 该反应的还原剂是Cl- | |
| B. | 反应后溶液的酸性明显增强 | |
| C. | 消耗1mol还原剂,转移6 mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为2:3 |
| 选项 | 实验 | 现象 | 结论 |
| A | 用玻璃棒蘸取次氯酸钠溶液,点在pH试纸上 | 试纸最终显蓝色 | 次氯酸钠溶液显碱性 |
| B | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH溶液中至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 白色沉淀变为蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
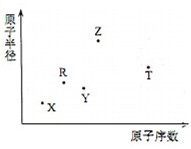 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )| A. | 形成的简单离子半径的大小顺序为T>Y>Z | |
| B. | Z2Y、Z2Y2所含有的化学键类型相同 | |
| C. | 0.005mol•L-1T的最高价氧化物对应水化物的水溶液pH等于2 | |
| D. | Z2T的水溶液显碱性,对水的电离有促进作用 |
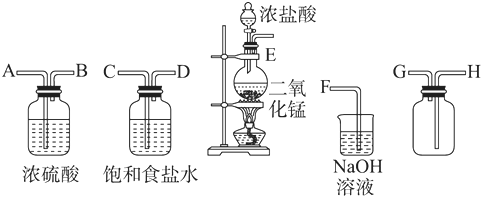
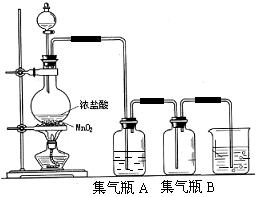 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O