题目内容
18. 某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )| A. | 反应2min末X的浓度为0.35mol/L | |
| B. | 该反应的化学方程式可表示为:2Z?2Y+3X | |
| C. | 反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min) | |
| D. | 任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y) |
分析 由图象可知2min时,△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.2-0)mol=0.2mol,同一反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.2mol:0.2mol=3:2:2,则方程式为3X+2Y?2Z,以此解答该题.
解答 解:A.反应2min末X的物质的量为0.7mol,则浓度为$\frac{0.7mol}{2L}$=0.35mol/L,故A正确;
B.由图象可知X、Y的物质的量减少,为反应物,Z的物质的量增大,为生成物,方程式为3X+2Y?2Z,故B错误;
C.反应2min内以Z浓度变化表示的平均反应速率为$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故C正确;
D.Y、Z的计量数相等,则任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y),故D正确.
故选B.
点评 本题考查图象分析,为高频考点,侧重考查学生分析及计算能力,明确曲线变化趋势含义、物质的量变化量与其计量数的关系即可解答,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
15. 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A. | 该反应的还原剂是Cl- | |
| B. | 反应后溶液的酸性明显增强 | |
| C. | 消耗1mol还原剂,转移6 mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为2:3 |
3.某种食用精制盐包装袋上有如表说明:
(1)写出碘酸钾与碘化钾在硫酸酸化条件下的化学方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O.
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中,上述操作正确的顺序是:abdc填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是$\frac{423}{w}$mg/kg.(以含w的代数式表示)
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体
d.将分液漏斗充分振荡后静置
其中,上述操作正确的顺序是:abdc填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是$\frac{423}{w}$mg/kg.(以含w的代数式表示)
10. 紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
(1)实验室中焙烧紫菜用到的仪器有DFGH(填写相应的字母).
A.烧杯 B.表面皿 C.蒸发皿 D.坩埚
E.试管 F.酒精灯 G.三脚架 H.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,其目的是将溶液中的I-转化为I2.
(3)过滤 (填一种基本操作的名称),弃去残渣,将所得的产物转入分液漏斗 (填一种玻璃仪器的名称)中,加入少量的四氯化碳 (填本题表格中一种最佳化学试剂的名称),振荡、静置,首先将紫色下层液体分离出来.
(4)将如图装置图中缺少的必要仪器补画出来以最终获得固态的单质碘(不考虑碘的进一步提纯): .
.
 紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.| 乙醇 | 四氯化碳 | 碘(晶体) | |
| 密度/g•cm-3 | 0.7893 | 1.595 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 184.35 |
A.烧杯 B.表面皿 C.蒸发皿 D.坩埚
E.试管 F.酒精灯 G.三脚架 H.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,其目的是将溶液中的I-转化为I2.
(3)过滤 (填一种基本操作的名称),弃去残渣,将所得的产物转入分液漏斗 (填一种玻璃仪器的名称)中,加入少量的四氯化碳 (填本题表格中一种最佳化学试剂的名称),振荡、静置,首先将紫色下层液体分离出来.
(4)将如图装置图中缺少的必要仪器补画出来以最终获得固态的单质碘(不考虑碘的进一步提纯):
 .
.
8.某有机物结构如图所示,有关该物质的叙述正确的是( )


| A. | 易溶于水 | |
| B. | 一氯代物有5种 | |
| C. | 最多能与氢气以物质的量之比1:4加成 | |
| D. | 碱性水解的产物之一是1-丙醇 |
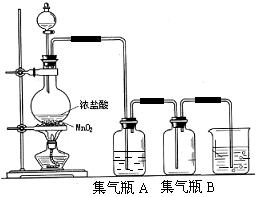 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O