题目内容
下列说法正确的是( )
| A、非金属元素组成的化合物中只可能含有共价键 |
| B、ⅦA族元素气态氢化物的热稳定性和还原性从上到下依次减弱 |
| C、第三周期非金属元素最高价含氧酸的酸性从左到右依次增强 |
| D、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
考点:元素周期律和元素周期表的综合应用,同一周期内元素性质的递变规律与原子结构的关系,共价键的形成及共价键的主要类型
专题:元素周期律与元素周期表专题
分析:A.非金属元素组成的化合物中可能存在离子键;
B.非金属元素的非金属性越强,其气态氢化物越稳定,其气态氢化物的还原性越弱;
C.非金属元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质.
B.非金属元素的非金属性越强,其气态氢化物越稳定,其气态氢化物的还原性越弱;
C.非金属元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质.
解答:
解:A.非金属元素组成的化合物中可能存在离子键,如铵盐,故A错误;
B.非金属元素的非金属性越强,其气态氢化物越稳定,其气态氢化物的还原性越弱,第VIIA族元素,其非金属性随着原子序数增大而减弱,所以ⅦA族元素气态氢化物的热稳定性从上到下依次减弱,其还原性从上到下依次增强,故B错误;
C.非金属元素的非金属性越强,其最高价氧化物的水化物酸性越强,第三周期非金属元素,其非金属性随着原子序数增大而增强,所以其最高价氧化物的水化物酸性依次增强,故C正确;
D.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质,可以作半导体材料,如Si,副族元素和第VIII族元素属于过渡元素,故D错误;
故选C.
B.非金属元素的非金属性越强,其气态氢化物越稳定,其气态氢化物的还原性越弱,第VIIA族元素,其非金属性随着原子序数增大而减弱,所以ⅦA族元素气态氢化物的热稳定性从上到下依次减弱,其还原性从上到下依次增强,故B错误;
C.非金属元素的非金属性越强,其最高价氧化物的水化物酸性越强,第三周期非金属元素,其非金属性随着原子序数增大而增强,所以其最高价氧化物的水化物酸性依次增强,故C正确;
D.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质,可以作半导体材料,如Si,副族元素和第VIII族元素属于过渡元素,故D错误;
故选C.
点评:本题涉及物质构成、元素周期律、元素周期表等知识点,为高考高频点,熟练掌握同一周期、同一主族元素周期律知识,并灵活运用,易错选项是A,注意不能根据是否含有金属元素判断离子键,要根据物质的构成微粒判断,为易错点.

练习册系列答案
相关题目
三氯生是一种抗菌剂,其结构如图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( ) 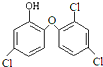

| A、三氯生的分子式是C12H7Cl3O2 |
| B、三氯甲烷与甲烷均无同分异构体 |
| C、1 mol三氯生最多能与6 mol H2反应 |
| D、1 mol三氯生最多能与4mol NaOH反应 |
已知金属钾有如下性质:①钾的密度比水小;②钾的熔点低;③钾与水反应时放出热量;④钾与水反应后溶液呈碱性.某学生将一小块金属钾投入滴有酚酞溶液的水中,以上实验能证明上述四点性质中的( )
| A、①④ | B、①②④ |
| C、①③④ | D、①②③④ |
下列装置能形成原电池的是( )
A、 |
B、 |
C、 |
D、 |
有下列三个反应:下列说法正确的是( )
①Cl2+FeI2═FeCl2+I2
②2Fe2++Br2═2Fe3++2Br-
③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O.
①Cl2+FeI2═FeCl2+I2
②2Fe2++Br2═2Fe3++2Br-
③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O.
| A、反应①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
| B、根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3 |
| C、在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
| D、可以推理得到Cl2+FeBr2═FeCl2+Br2 |
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A、W得电子能力比Q强 |
| B、由Z与Y组成的物质在熔融时能导电 |
| C、钠与Y可能形成Na2Y2化合物 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
设NA为阿伏加德罗常数的值.下列说法正确是( )
| A、标准状况下,2.24 L三氯甲烷中含有碳氯共价健的数目为0.3NA |
| B、25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| C、常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA |
| D、0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA |
设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
| B、200mL某硫酸强碱盐中含有1.5NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5mol/L |
| C、常温常压下78g Na2O2固体中所含阴、阳离子总数为4NA |
| D、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA |
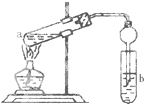 如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.