题目内容
17.由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是( )| A. | 镁和铁 | B. | 钠和铁 | C. | 锌和铜 | D. | 铁和铜 |
分析 两种金属的混合物共4.8克,与足量氯气反应后,消耗氯气为2.24L,物质的量为0.1mol,故反应中,4.8g金属提供0.2mol电子,故提供1mol电子需要金属的平均质量为4.8g×$\frac{1mol}{0.2mol}$=24g,据此计算提供1mol需要各金属的质量,利用平均值法判断.
解答 解:两种金属的混合物共4.8克,与足量氯气反应后,消耗氯气为2.24L,物质的量为0.1mol,故反应中,4.8g金属提供0.2mol电子,故提供1mol电子需要金属的平均质量为4.8g×$\frac{1mol}{0.2mol}$=24g,据此计算提供1mol需要各金属的质量,利用平均值法判断.
A、提供1mol电子需要金属Mg的物质的量为0.5mol,质量为0.5mol×24g/mol=12g,提供1mol电子需要金属Fe的物质的量为$\frac{1}{3}$mol,质量为$\frac{1}{3}$mol×56g/mol=18.7g,二者混合提供1mol电子的平均质量介于12g~18.7g之间,故A不符合;
B、提供1mol电子需要金属Na的物质的量为1mol,质量为1mol×23g/mol=23g.提供1mol电子需要金属Fe的物质的量为$\frac{1}{3}$mol,质量为$\frac{1}{3}$mol×56g/mol=18.7g,二者混合提供1mol电子的平均质量介于18.7g~23g之间,故B不符合;
C、提供1mol电子需要金属Zn的物质的量为0.5mol,质量为0.5mol×65g/mol=32.5g.提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于32g~32.5g之间,故C不符合;
D、提供1mol电子需要金属Fe的物质的量为$\frac{1}{3}$mol,质量为$\frac{1}{3}$mol×56g/mol=18.7g,提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于18.7g~32g之间,故D符合;
故选D.
点评 本题考查混合物的计算,难度中等,注意利用提供1mol电子需要金属质量的平均值进行的判断,注意反应金属的化合价.

| A. | ②④⑤ | B. | ②④⑦ | C. | ④⑥⑦ | D. | ①③⑥ |
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
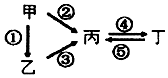 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | S | H2S | SO3 | H2SO4 |
| C | N2 | NH3 | NO | NO2 |
| D | Si | SiO2 | Na2SiO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 碘是人体内必须的微量元素,所以富含高碘酸的食物适合于所有人群 | |
| B. | 化石燃料不完全燃烧会产生CO造成污染,完全燃烧不会造成大气污染 | |
| C. | 利用铁比铜金属性强的性质,常用FeCl3溶液腐蚀Cu来刻制印刷电路板 | |
| D. | 中国古代利用明矾溶液清除铜镜表面的铜镑,是利用了明矾溶液的酸性 |
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | Na+不断向“水”电池的负极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
| A. | 钌催化剂能加快该反应的速率 | |
| B. | 升高温度能加快该反应的速率 | |
| C. | 当达到一定限度时,CO2能100%转化为CH4 | |
| D. | 当达到一定限度时,反应速率:v(正)=v(逆)=0,反应停止 |
| A. | $\frac{9a}{700}$ | B. | $\frac{3a}{700}$ | ||
| C. | 0 | D. | 缺少条件,无法计算 |