题目内容
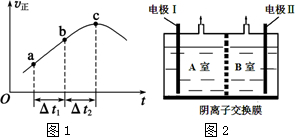
4. 常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | HA和MOH均为弱电解质 | |
| B. | 曲线a中,滴加溶液到20mL时,c(Cl-)=c(M+)=c(OH-)=c(H+) | |
| C. | 曲线b中,滴加溶液到20mL时,c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 曲线b中,滴加溶液到10mL时,c(A-)+c(OH-)=c(H+)+c(HA) |
分析 A.由图可知,0.01mol•L-1的HA溶液pH>2,则HA为弱酸,而0.01mol•L-1 MOH溶液的pH=12,则MOH为强碱;
B.曲线a中,滴加溶液到20mL时,此时为MCl溶液,为强酸强碱盐,溶液呈中性,盐的离子远远大于水电离的氢氧根离子(或氢离子)浓度;
C.曲线b中,滴加溶液到20mL时,此时为NaA溶液,为强碱弱酸盐,溶液呈碱性;
D.曲线b中,滴加溶液到10mL时,此时为NaA、HA混合物溶液,二者浓度相等,由图可知溶液呈酸性,HA的电离程度大于A-的水解程度,结合电荷守恒判断.
解答 解:A.由图可知,0.01mol•L-1的HA溶液pH>2,则HA为弱酸,而0.01mol•L-1 MOH溶液的pH=12,则MOH为强碱,故A错误;
B.曲线a中,滴加溶液到20mL时,此时为MCl溶液,为强酸强碱盐,溶液呈中性,盐的离子远远大于水电离的氢氧根离子(或氢离子)浓度,即c(Cl-)=c(M+)>c(OH-)=c(H+),故B错误;
C.曲线b中,滴加溶液到20mL时,此时为NaA溶液,为强碱弱酸盐,溶液呈碱性,则离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故C正确;
D.曲线b中,滴加溶液到10mL时,此时为NaA、HA混合物溶液,二者浓度相等,由图可知溶液呈酸性,HA的电离程度大于A-的水解程度,则溶液中c(HA)<c(Na+),由电荷守恒可知c(A-)+c(OH-)=c(H+)+c(Na+),则:c(A-)+c(OH-)>c(H+)+c(HA),故D错误.
故选:C.
点评 本题以中和滴定为载体,考查弱电解质电离、盐类水解、离子浓度大小比较,注意根据未滴定时pH判断强弱电解质,混合后先判断反应后溶质再判断离子浓度问题,注意电荷守恒、微粒守恒、质子恒等式.

| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |
| A. | 0.1mol/LCH3COOH溶液,加水稀释过程中,所有离子浓度均减小 | |
| B. | 浓度均为0.1mol/L的NaF、CH3COONa溶液相比较,CH3COONa溶液pH大 | |
| C. | 反应HF+CH3COONa═NaF+CH3COOH可以发生 | |
| D. | NaF溶液中加少量NaOH固体,溶液中c(F-)变大 |
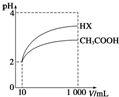 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
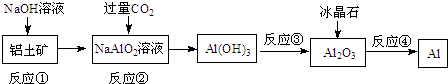
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | B元素不能形成共价化合物 | |
| B. | 离子半径大小A+>D2- | |
| C. | A和E形成的化合物中只可能含离子键 | |
| D. | B和E的化合物不能溶于氨水 |
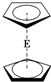 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为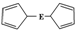 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )| A. | 5,5 | B. | 3,5 | C. | 5,1 | D. | 3,1 |
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | WX2与ZY2中的化学键类型相同 |