题目内容
12.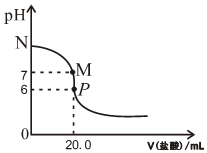 298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.
298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.①为减小实验误差,由图可知滴定时指示剂应选用甲基橙
(填“石蕊”、“酚酞”、“甲基橙”)
②N、M、P三点所示溶液导电能力最强的是P对应的溶液;M点对应离子浓度大小关系为c(Cl-)=c(NH4+)>c(H+)=c(OH-).
③25℃时,N点c(OH-)为$\sqrt{2}$×10-2 mol/L.
分析 ①该实验是酸滴定碱,二者恰好完全反应时生成的盐是强酸弱碱盐,溶液呈酸性,甲基橙变色较明显;
②溶液导电性与离子浓度成正比,N点溶液中溶质为一水合氨、M点溶液中溶质为氯化铵和一水合氨、P点溶液中溶质为氯化铵;M点溶液呈中性,再结合电荷守恒判断离子浓度大小;
③N点二者恰好完全反应生成氯化铵,溶液中Kh=$\frac{{c}^{2}({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{1{0}^{-6}×1{0}^{-6}}{0.10}$=10-11,Kb=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3,一水合氨溶液中Kb=$\frac{{c}^{2}(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$.
解答 解:①该实验是酸滴定碱,二者恰好完全反应时生成的盐是强酸弱碱盐,溶液呈酸性,甲基橙变色较明显,所以选甲基橙作指示剂,故答案为:甲基橙;
②溶液导电性与离子浓度成正比,N点溶液中溶质为一水合氨、M点溶液中溶质为氯化铵和一水合氨、P点溶液中溶质为氯化铵,N、M、P点溶液中离子浓度最大的是P,所以导电性最强的是P;M点溶液呈中性,溶质为氯化铵和一水合氨,水的电离程度很小,根据电荷守恒得c(Cl-)=c(NH4+),离子浓度大小顺序是,
故答案为:P;c(Cl-)=c(NH4+)>c(H+)=c(OH-);
③N点二者恰好完全反应生成氯化铵,溶液中Kh=$\frac{{c}^{2}({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{1{0}^{-6}×1{0}^{-6}}{0.10}$=10-11,Kb=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3,一水合氨溶液中Kb=$\frac{{c}^{2}(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$,则c(OH-)=$\sqrt{{K}_{b}.c(N{H}_{3}.{H}_{2}O)}$=$\sqrt{1{0}^{-3}×0.2}$mol/L=$\sqrt{2}$×10-2 mol/L,
故答案为:$\sqrt{2}$×10-2 mol/L.
点评 本题考查酸碱混合溶液定性判断及有关计算,为高频考点,侧重考查学生分析计算能力,明确一水合氨电离平衡常数与盐类水解平衡常数关系是解本题关键,题目难度中等.

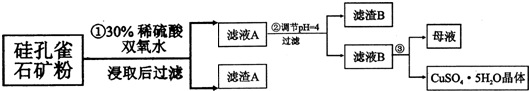
(1)步骤1中先加入足量稀硫酸,再加人双氧水.则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.A12O3 B.CuO C.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4.取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol.则a=$\frac{2}{5}$b-8.(氧气占空气体积的五分之一)
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol•L-1计算)如表所示.
| Fe3+ | Cr3+ | Ni2+ | |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答下列问题:
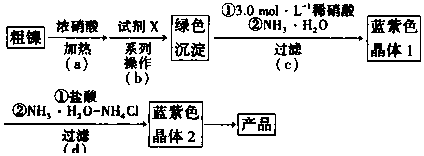
(1)实验需要配制3.0mol•L-1稀硝酸250mL.需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和250mL容量瓶.
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为Ni+4(浓)HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Ni(NO3)2+2NO2↑+2H2O.
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀.
①调节pH约为6的原因是使Cr3+、Fe3+完全沉淀,而Ni2+未开始沉淀
②试剂X可以是C(填标号).
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有降低温度以降低产物的溶解度而析出
(5)NH3含量的测定.[已知:Ni(NH3)6Cl2+6HCl=NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入5mL的6mol•L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0mol•L-1 NaOH标准溶液V1mL.
ii.空白试验:不加入样品重复实验i.消耗NaOH标准溶液V2 mL.
①NH3的质量分数为$\frac{(V{\;}_{2}-V{\;}_{1})×10{\;}^{-3}×8.5}{m}$×100%.
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有AD(填标号).
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸C.用酚酞替代甲基橙 D.进行平行试验.
 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
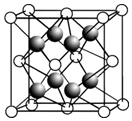
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol•L-1的盐酸来滴定待测溶液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视眼睛注视锥形瓶中溶液颜色变化;在铁架台上垫一张白纸,其目的是便于观察溶液颜色变化.
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol•L-1,烧碱样品的纯度是97.56%.
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果偏高.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
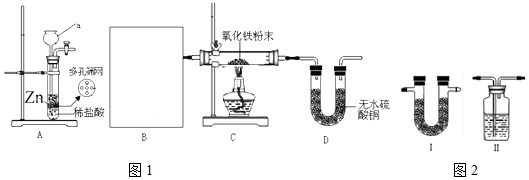
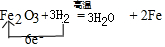 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.