��Ŀ����
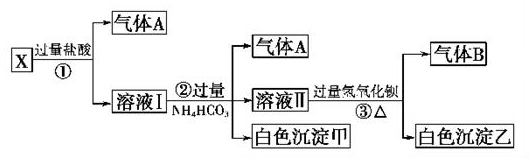
18����ѧ��ȤС���ͬѧȡһ������ij��ʽ̼��ͭ����[Cu2��OH��2CO3•2H2O]Ͷһ������ˮ�У�����������μ���ϡ���ᣮ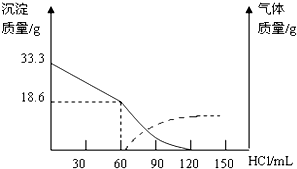
��1��ijͬѧͨ��ʵ��õ����������������������������Ĺ�ϵ��ͼ��������60mL����ʱ���ܻ�ѧ��Ӧ����ʽΪCu2��OH��2CO3+2HCl=CuCO3��+CuCl2+2H2O
��Cu2��OH��2CO3��2H2O+2HCl=CuCO3��+CuCl2+4H2O����
��2������ȫ��Ӧ�����������ȫ��ͨ��100g 8%��NaOH��Һ�г�ַ�Ӧ��������Һ������������Ϊ13.7g��
���� ��1��Cu2��OH��2CO3•2H2O����ˮʱ���ᾧˮ��ʧȥ����ʼʱ����ΪCu2��OH��2CO3��n��Cu2��OH��2CO3��=$\frac{33.3g}{222g/mol}$=0.15mol������ϡ����60mLʱû���������ɣ�˵��Cu2��OH��2CO3�����������Ӻ�ϡ���ᷴӦ��������60mL�����������ɣ�˵����ʱ̼������Ӻ�ϡ���ᷴӦ��
��2������Cԭ���غ��n��CO2��=n[Cu2��OH��2CO3]=0.15mol��100g 8%��NaOH��Һ��n��NaOH��=$\frac{100g��8%}{40g/mol}$=0.2mol��1��$\frac{n��NaOH��}{n��C{O}_{2}��}$��2��˵��������̼��NaOH��Ӧ��̼���ơ�̼���������ɣ�
��̼���ơ�̼�����Ƶ����ʵ����ֱ�Ϊxmol��ymol������Cԭ�ӡ�Naԭ���غ��з�����������ʵ�������
��� �⣺��1��Cu2��OH��2CO3•2H2O����ˮʱ���ᾧˮ��ʧȥ����ʼʱ����ΪCu2��OH��2CO3��n��Cu2��OH��2CO3��=$\frac{33.3g}{222g/mol}$=0.15mol������ϡ����60mLʱû���������ɣ�˵��Cu2��OH��2CO3�����������Ӻ�ϡ���ᷴӦ��������60mL�����������ɣ�˵����ʱ̼������Ӻ�ϡ���ᷴӦ�����Է�Ӧ����ʽΪCu2��OH��2CO3+2HCl=CuCO3��+CuCl2+2H2O��Cu2��OH��2CO3��2H2O+2HCl=CuCO3��+CuCl2+4H2O����
�ʴ�Ϊ��Cu2��OH��2CO3+2HCl=CuCO3��+CuCl2+2H2O��Cu2��OH��2CO3��2H2O+2HCl=CuCO3��+CuCl2+4H2O����
��2������Cԭ���غ��n��CO2��=n[Cu2��OH��2CO3]=0.15mol��100g 8%��NaOH��Һ��n��NaOH��=$\frac{100g��8%}{40g/mol}$=0.2mol��1��$\frac{n��NaOH��}{n��C{O}_{2}��}$��2��˵��������̼��NaOH��Ӧ��̼���ơ�̼���������ɣ�
��̼���ơ�̼�����Ƶ����ʵ����ֱ�Ϊxmol��ymol������Cԭ�ӡ�Naԭ���غ��з������
$\left\{\begin{array}{l}{x+y=0.15}\\{2x+y=0.2}\end{array}\right.$�����$\left\{\begin{array}{l}{x=0.05}\\{y=0.1}\end{array}\right.$
�����ʵ�����=m��Na2CO3��+m��NaHCO3��=0.05mol��106g/mol+0.1mol��84g/mol=13.7g��
�ʴ�Ϊ��13.7g��
���� ���⿼�黯ѧ����ʽ�йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷͼ�����߱仯ʱ�����ķ�Ӧ�ǽⱾ��ؼ���ע�⣨2��ԭ���غ��������ã���Ŀ�ѶȲ���

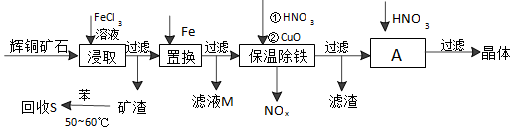
 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
��1������һ����ַ�Ӧ���˳�ȥCaSO4���������һ����ʵ�飬�����������������Һ���Ƿ���SO42-��ȡ������Һ���Թ��У��μ�BaCl2��Һ����������ɫ��������˵������SO42-����֮��˵������SO42-
��2���������������������Һ��ZnO��ϣ�ʹ���ַ�Ӧ������������������Һ��pHΪ5.8����Ŀ��������Zn2+��ˮ�� ���������ʿ����ZnO����b������ĸ����
a��NH3•H2O b��Zn��OH��2 c��NaOH d��ZnSO4
��3�������������ҺŨ����ԭ�������$\frac{1}{3}$������������ˮ�Ҵ�������8h���ϣ����ᾧ�����롢��������������п���壮��������м�����ˮ�Ҵ���Ŀ���ǽ�����������п���ܽ�ȣ���������ᾧ������
��4���±��г�����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0mol•L-1���㣩��
| �������� | ��ʼ������pH | ������ȫ��pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 5.2 | 6.4 |
��ȡ��������������KMnO4��Һ���ȣ�������ҺpH��3.2��5.2 ����д��Χ������ȥ��Һ��FeԪ�أ�
�ڼ��������п�ۣ����ˣ��������м�������ϡ���ᣬ�������ˣ���������Һ�ϲ��ýϸߴ��ȵ�����п��Һ��
�۽���������������������п��Һ�У��ü�ʽ̼��п[�仯ѧʽΪZn2��OH��2CO3]��ͬʱ����ɫ���������д���÷�Ӧ�����ӷ���ʽ��2CO32-+2Zn2++H2O=Zn2��OH��2CO3��+CO2����
�ܹ��ˡ�ϴ�ӣ����������յû�������п������������Ҫ����Ҫ�����У��ƾ��ơ������������żܡ������ǡ�����������ǯ�ȣ�
| A�� | ľ̿��������ȼ�գ������⣬�ų�������������ʹ����ʯ��ˮ����ǵ����� | |
| B�� | ϸ��˿�ڿ��������ȼ�գ��������䣬���ɺ�ɫ�������� | |
| C�� | ����������ȼ�գ�������ɫ���棬������ɫ�д̼�����ζ������ | |
| D�� | ����ͭ��ʱ�����ɺ�ɫ����ͭ���� |
| A�� | KAl��SO4��2�TK++Al3++SO42- | B�� | NaH2PO4�TNa++H2PO4- | ||
| C�� | H2S?2H++S2- | D�� | NaClO�TNa++Cl-+O2- |
| A�� | 0.15NA | B�� | 0.6NA | C�� | 1.2NA | D�� | 2.4NA |
 ͭ�ǹ��ɽ���Ԫ�أ������γɶ��ֻ����
ͭ�ǹ��ɽ���Ԫ�أ������γɶ��ֻ����