题目内容
8.甲烷与氧气的质量比为1:4时极易爆炸,若参与爆炸的甲烷在标准状况下的体积是3.36L,用NA表示阿伏加德罗常数的值,则该爆炸中转移的电子数是( )| A. | 0.15NA | B. | 0.6NA | C. | 1.2NA | D. | 2.4NA |
分析 甲烷爆炸生成二氧化碳气体和水,甲烷中C的化合价为-4价,反应生成产物CO2中C元素的化合价为+4价,则1mol甲烷完全反应转移电子的物质的量为:1mol×[4-(-4)]=8mol;然后根据n=$\frac{V}{{V}_{m}}$计算出标准状况下3.36L甲烷的物质的量,然后计算出转移电子的物质的量及数目.
解答 解:标准状况下3.36L甲烷的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,
甲烷爆炸生成二氧化碳气体和水,甲烷中C的化合价为-4价,反应生成产物CO2中C元素的化合价为+4价,则1mol甲烷完全反应转移电子的物质的量为:1mol×[4-(-4)]=8mol,
则0.15mol甲烷完全反应转移电子的物质的量为:0.15mol×8=1.2mol,转移的电子数为1.2NA,
故选C.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握氧化还原反应的实质及特征,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
3.某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如表:
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2504mL(标准状况).
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式.
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为2.5mol/L.
(4)依据表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式.
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式.
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为2.5mol/L.
(4)依据表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式.
13.对于反应E(g)+2F(g)?2G(s),在温度T1和T2时,分别将0.50mol E和1.0mol F充入体积为2L的密闭容器中,测得n(E)随时间变化数据如表:
下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(E) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(E) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(T1)>K(T2) | |
| C. | T2温度下10min内,平均速率为v(E)=0.020mol•L-1•min-1 | |
| D. | T1温度下达到平衡后,再充入0.50mol E和1.0mol F,达到新平衡时E的浓度不变 |

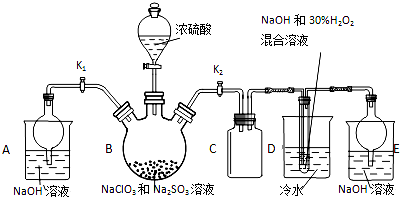 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答: