题目内容
下列说法不正确的是( )
| A、一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B、常温下,向Mg(OH)2饱和溶液中加入NaOH溶液,Mg(OH)2的Ksp不变 |
| C、带有“盐桥”的铜锌原电池比不带“盐桥”的铜锌原电池电流持续时间长 |
| D、对滴加酚酞的NaHCO3溶液加热,红色加深,是因为加热时NaHCO3分解生成Na2CO3,碱性增强 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,原电池和电解池的工作原理,影响盐类水解程度的主要因素
专题:
分析:A、当可逆反应达到平衡状态时,正逆反应速率相等,反应达到化学反应限度,此时各物质的浓度不再发生改变;
B、Ksp只受温度影响,与离子浓度大小无关;
C、有盐桥的原电池可以防止锌与硫酸铜溶液接触反应;
D、碳酸氢根离子水解反应为吸热反应,水解生成碳酸和氢氧根离子.
B、Ksp只受温度影响,与离子浓度大小无关;
C、有盐桥的原电池可以防止锌与硫酸铜溶液接触反应;
D、碳酸氢根离子水解反应为吸热反应,水解生成碳酸和氢氧根离子.
解答:
解:A.当可逆反应达到平衡状态时,各物质的浓度不再发生改变,反应达到化学反应限度,故A正确;
B、Ksp只受温度影响,与离子浓度大小无关,故B正确;
C、有盐桥的原电池可以防止锌与硫酸铜溶液接触反应,故C正确;
D、碳酸氢根离子水解反应为吸热反应,水解生成碳酸和氢氧根离子,则加热后碱性增强,所以红色加深,与水解有关,与分解无关,故D错误;
故选D.
B、Ksp只受温度影响,与离子浓度大小无关,故B正确;
C、有盐桥的原电池可以防止锌与硫酸铜溶液接触反应,故C正确;
D、碳酸氢根离子水解反应为吸热反应,水解生成碳酸和氢氧根离子,则加热后碱性增强,所以红色加深,与水解有关,与分解无关,故D错误;
故选D.
点评:本题考查了化学反应的限度、沉淀的溶度积、盐桥、碳酸氢钠溶液的碱性,注意在溶液中碳酸氢钠加热不分解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
常温时,①pH=2的CH3COOH溶液; ②pH=2的HCl溶液; ③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,不正确的是( )
| A、由水电离的c(H+):①=②=③=④ |
| B、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| C、将②、③溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| D、四种溶液均稀释100倍后,溶液的pH:③>④>②>① |
一个真空恒容密闭容器中盛有2mol PCl5,加热到200℃发生了反应PCl5(g)?PCl3(g)+Cl2(g),
反应达到平衡时PCl5的分解率为a%.若在同一温度下和同样容器中最初投入的是1mol PCl5,反应达到平衡时PCl5的分解率为b%,a与b的关系是( )
反应达到平衡时PCl5的分解率为a%.若在同一温度下和同样容器中最初投入的是1mol PCl5,反应达到平衡时PCl5的分解率为b%,a与b的关系是( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
将0.02mol Na别投入到盛有100mL水、100mL 1mol?L-1盐酸、100mL 1mol?L-1硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A、三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ |
| B、三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 |
| C、Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 |
| D、三个烧杯中生成氢气体的物质的量相同 |
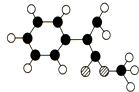
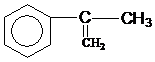 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: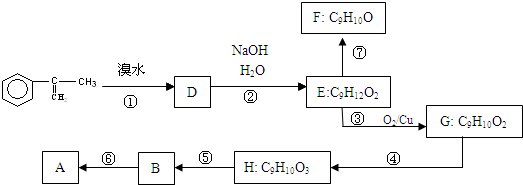
 T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol.
T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol.