题目内容
 T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol.
T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol.(1)T℃时,该反应的平衡常数K的数值为
(2)另有容器乙和丙均分别充入2molSO2、1molO2,起始容器容积与甲相同,起始温度均为T℃.在反应过程中乙容器保持温度和压强不变,丙容器保持容器体积不变并与外界绝热,分别建立平衡后:
①三个容器中反应的平衡常数K:K(甲)
②达到平衡时,甲、乙、丙三容器中,SO2的转化率α最小的是
(3)若向上述容器甲的平衡体系中继续充入2mol SO2和1mol O2,在相同温度下再次达到平衡后,SO3的物质的量
a.2.4mol b.大于1.2mol,小于2.4mol c.大于2.4mol.
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据化学平衡常数K=生成物的浓度幂之积除以反应物的浓度幂之积来计算;
(2)①2SO2(g)+O2(g)?2SO3(g)△H<0,正反应放热,升温,平衡逆向移动,化学平衡常数只与温度有关;
②达到平衡时,由于甲乙的平衡常数相同,SO2的转化率α相等,丙相对甲乙平衡逆向移动,SO2的转化率α最小;
混合气体密度ρ=
,混合气体的质量不变,丙平衡逆向移动,气体体积变大,ρ变小,平衡正向移动,气体体积变小;
(3)恒温恒容条件下,反应达到平衡时继续充入2mol SO2和1mol O2,达到新的平衡状态,该状态可以等效为开始加入时4molO2和2molSO2,所到达的平衡状态,与原平衡相比,增大了压强,平衡向正反应移动,SO3的物质的量增加.
(2)①2SO2(g)+O2(g)?2SO3(g)△H<0,正反应放热,升温,平衡逆向移动,化学平衡常数只与温度有关;
②达到平衡时,由于甲乙的平衡常数相同,SO2的转化率α相等,丙相对甲乙平衡逆向移动,SO2的转化率α最小;
混合气体密度ρ=
| m |
| V |
(3)恒温恒容条件下,反应达到平衡时继续充入2mol SO2和1mol O2,达到新的平衡状态,该状态可以等效为开始加入时4molO2和2molSO2,所到达的平衡状态,与原平衡相比,增大了压强,平衡向正反应移动,SO3的物质的量增加.
解答:
解:(1)2SO2(g)+O2(g)?2SO3(g)
起始(mol/L) 2 1 0
变化(mol/L) 1.2 0.6 1.2
平衡(mol/L) 0.8 0.4 1.2
平衡常数K=
=
=5.6
故答案为:5.6;
(2)①2SO2(g)+O2(g)?2SO3(g)△H<0,正反应放热,升温,平衡逆向移动.乙的压强、温度不变,平衡常数与甲的相等,丙与外界绝热,因为反应放热,温度升高,平衡逆向移动,导致平衡常数K=
变小,存在K(甲)=K(乙)>K(丙)关系;
故答案为:=;>;
②达到平衡时,由于甲乙的平衡常数相同,SO2的转化率α相等,丙相对甲乙平衡逆向移动,SO2的转化率α最小;
混合气体密度ρ=
,混合气体的质量不变,反应2SO2(g)+O2(g)?2SO3(g)是一个气体体积减小的反应,丙平衡逆向移动,气体体积变大,ρ变小,乙相对甲压强变大,平衡正向移动,气体体积变小,ρ变大,故丙的密度最大;
故答案为:丙;乙;
(3)恒温恒容条件下,反应达到平衡时继续充入2mol SO2和1mol O2,达到新的平衡状态,该状态可以等效为开始加入时4molO2和2molSO2,所到达的平衡状态,与原平衡相比,增大了压强,平衡向正反应移动,SO3的物质的量增加,但转化率不会增大到原来的2倍,即SO3的物质的量大于1.2mol,小于2.4mol.
故答案为:b.
起始(mol/L) 2 1 0
变化(mol/L) 1.2 0.6 1.2
平衡(mol/L) 0.8 0.4 1.2
平衡常数K=
| c2(SO3) |
| c2(SO2)?c(O2) |
| 1.22 |
| 0.82×0.4 |
故答案为:5.6;
(2)①2SO2(g)+O2(g)?2SO3(g)△H<0,正反应放热,升温,平衡逆向移动.乙的压强、温度不变,平衡常数与甲的相等,丙与外界绝热,因为反应放热,温度升高,平衡逆向移动,导致平衡常数K=
| c2(SO3) |
| c2(SO2)?c(O2) |
故答案为:=;>;
②达到平衡时,由于甲乙的平衡常数相同,SO2的转化率α相等,丙相对甲乙平衡逆向移动,SO2的转化率α最小;
混合气体密度ρ=
| m |
| V |
故答案为:丙;乙;
(3)恒温恒容条件下,反应达到平衡时继续充入2mol SO2和1mol O2,达到新的平衡状态,该状态可以等效为开始加入时4molO2和2molSO2,所到达的平衡状态,与原平衡相比,增大了压强,平衡向正反应移动,SO3的物质的量增加,但转化率不会增大到原来的2倍,即SO3的物质的量大于1.2mol,小于2.4mol.
故答案为:b.
点评:本题考查了化学平衡常数、化学反应速率的计算及化学平衡的影响因素等知识,题目难度中等,试题涉及的知识面广,应加强平时知识的积累,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列分子的结构中,原子的最外层电子不都满足8e-稳定结构的是( )
| A、CO2 |
| B、PCl3 |
| C、CCl4 |
| D、BF3 |
下列说法不正确的是( )
| A、一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B、常温下,向Mg(OH)2饱和溶液中加入NaOH溶液,Mg(OH)2的Ksp不变 |
| C、带有“盐桥”的铜锌原电池比不带“盐桥”的铜锌原电池电流持续时间长 |
| D、对滴加酚酞的NaHCO3溶液加热,红色加深,是因为加热时NaHCO3分解生成Na2CO3,碱性增强 |
下列实验装置能达到相应实验目的是( )


| A、图1装置一定可以制得乙烯 |
| B、图2装置可以证明CH3CH2OH发生消去反应生成了乙烯 |
| C、图3所示装置可以证明碳酸酸性强于苯酚 |
| D、实验室常用图4所示装置制取少量的乙酸乙酯 (夹持物略) |
下列实验的相关描述正确的是( )


| A、快速分离氢氧化铁胶状沉淀和氯化钠溶液可用抽滤法 |
| B、常温下,苯酚与水形成的浊液静置后会分层,上层为溶有水的苯酚溶液 |
| C、甲装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 |
| D、乙装置可用来制取和检验二氧化硫气体漂白性,待滤纸颜色褪去后立即用浸有碱液的棉花堵住试管口 |
下列关于金属钠的叙述错误的是( )
| A、金属钠可以保存在煤油中 |
| B、金属钠着火时,可用泡沫灭火器来灭火 |
| C、钠与熔融的四氯化钛反应可制取钛 |
| D、实验时用剩的钠块应该放回原试剂瓶 |
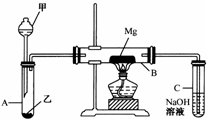 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.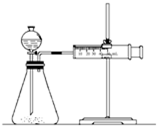 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.