题目内容
1.下列有关叙述正确的是( )| A. | 用无水酒精萃取碘水中的碘 | |
| B. | Na2O2粉末加人到FeSO4溶液中.产生白色沉淀,并放出大量气泡 | |
| C. | 将浓氨水滴加到碱石灰中可制得氨气,也可用碱石灰干燥氨气 | |
| D. | 往酸性KMnO4溶液中通人SO2验证SO2的漂白性 |
分析 A.根据萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
B.Na2O2粉末加人到FeSO4溶液中,反应生成氢氧化铁和硫酸钠和氧气;
C.碱石灰中的CaO吸收了浓氨水中的水反应,反应过程中放热降低了氨气溶解度,溶液中一水合氨分解生成氨气;
D.向酸性KMnO4溶液中通入SO2,发生氧化还原反应生成硫酸根离子,高锰酸根离子被还原为无色的二价锰离子.
解答 解:A.酒精和水互溶,所以酒精不能作萃取剂,故A错误;
B.Na2O2粉末加人到FeSO4溶液中,反应生成氢氧化铁和硫酸钠和氧气,产生红褐色沉淀和氧气,故B错误;
C.碱石灰中的CaO吸收了浓氨水中的水反应,反应过程中放热降低了氨气溶解度,溶液中一水合氨分解生成氨气,所以将浓氨水滴加到碱石灰中可制得氨气,也可用碱石灰干燥氨气,故C正确;
D.二氧化硫具有还原性,与酸性的高锰酸钾发生氧化还原反应使高锰酸钾褪色,体现二氧化硫还原性,故D错误;
故选:C.
点评 本题考查了元素化合物知识,明确萃取原理,氨气、二氧化硫的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
11.关于如图所示装置的叙述,不正确的是( )
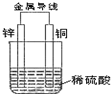

| A. | 铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电子从锌片经导线流向铜 | D. | 该装置把化学能转化为电能 |
12.下列措施或事实能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照下颜色逐渐变浅 | |
| B. | H2、I2、HI平衡混合气缩小体积加压后颜色变深 | |
| C. | 工业上生产硫酸的过程中,SO2在催化氧化时条件控制为常压,而不是高压 | |
| D. | 工业上合成氨气时温度选择450℃左右,而不是常温 |
16.用惰性电解电解饱和食盐水时,阴极发生的离子反应方程式为( )
| A. | 2H++2e→H2↑ | B. | 2H20+2C1-→H2↑+C12↑+20H- | ||
| C. | 2Cl--2e→Cl2↑ | D. | 2H20+2NaCl→H2↑+Cl2↑+2Na0H |
6.W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W原子在周期表中原子半径最小,X与Y原子最外层电子数之和为8,X的最高正价与最低负价代数和为2,Z原子的最外层电子数是Y原子最外层电子数的2倍,下列说法正确的是( )
| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的简单离子均能抑制水的电离 |
13.1mol铁铜混合物中,加入一定量的稀硝酸,下列对溶液中最终存在的离子的判断中正确的是( )
| A. | 可能含有Fe2+和Fe3+ | B. | 可能含有Fe2+和Cu2+ | ||
| C. | 可能含有Cu2+和Fe3+ | D. | 可能含有单质铜和Fe3+ |
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na2CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d (填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
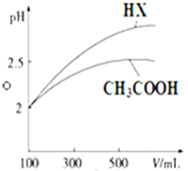
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(保留两位有效数字).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na2CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d (填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(保留两位有效数字).
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题: