题目内容
10.现需要0.1mol/L的NaOH溶液480mL,实验室用固体烧碱来配制,请回答:(1)计算称取的NaOH固体的质量是2.0g;
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平 ⑦量筒.配制时,必须使用的玻璃仪器有①④⑤(填序号),还缺少的玻璃仪器是胶头滴管;
(3)使用容量瓶前必须进行的一步操作是检漏;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为⑤②①③④(填序号);①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移.
(5)配制过程中,下列操作会引起结果偏高的是③④(填序号);
①未洗涤烧杯、玻璃棒;②称量NaOH的时间太长;③定容时俯视刻度;④NaOH溶液未冷却至室温就转移到容量瓶中.
(6)现将200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH-的物质的量浓度是0.016mol/L.
分析 (1)需要0.1mol/L的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(2)依据配制溶液的一般步骤选择需要的玻璃仪器,确定缺少的玻璃仪器;
(3)容量瓶带有活塞,使用前应先检查是否漏水;
(4)依据配制溶液的一般步骤排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)计算氢氧化钠和氢氧化钙中含有氢氧根离子总的物质的量,依据C=$\frac{n}{V}$计算混合后溶液中氢氧根离子浓度.
解答 解:(1)需要0.1mol/L的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,所以需要的玻璃仪器为:①烧杯 ④500mL容量瓶 ⑤玻璃棒;还缺少的仪器:胶头滴管;
故答案为:①④⑤,胶头滴管;
(3)容量瓶带有活塞,使用前应先检查是否漏水;
故答案为:检漏;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:⑤②①③④;
故答案为:⑤②①③④;
(5)①未洗涤烧杯、玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
②称量NaOH的时间太长,氢氧化钠吸收空气中水和二氧化碳,导致称取的氢氧化钠的物质的量偏小,溶液浓度偏低,故不选;
③定容时俯视刻度,导致溶液体积偏小,溶液浓度偏高,故选;
④NaOH溶液未冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶液的物质的量浓度偏高,故选;
故选:③④;
(6)200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合所含的氢氧根离子物质的量n=0.2L×0.01mol/L+0.02mol/L×2×0.05L=0.004mol,则混合后溶液中氢氧根离子物质的量浓度C=$\frac{0.004mol}{0.25L}$=0.016mol/L;
故答案为:0.016.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制过程及有关物质的量浓度计算是解题关键,注意误差分析的方法,题目难度不大.

| A. | 用无水酒精萃取碘水中的碘 | |
| B. | Na2O2粉末加人到FeSO4溶液中.产生白色沉淀,并放出大量气泡 | |
| C. | 将浓氨水滴加到碱石灰中可制得氨气,也可用碱石灰干燥氨气 | |
| D. | 往酸性KMnO4溶液中通人SO2验证SO2的漂白性 |
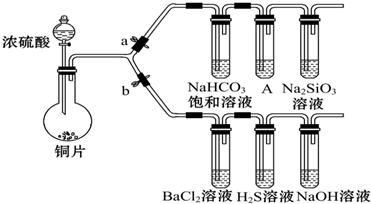
(1)验证SO2的氧化性、还原性和酸性氧化物的通性.
①若大量的SO2通入NaOH溶液中,其离子方程式是:SO2+NaOH═NaHSO3
②打开b,关闭a.能验证SO2具有氧化性的化学方程式是:2H2S+SO2═3S↓+2H2O.
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
(2)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置A中的试剂是酸性KMnO4溶液.
②连接仪器、检验装置的气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不退色,Na2SiO3溶液中出现白色沉淀.
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
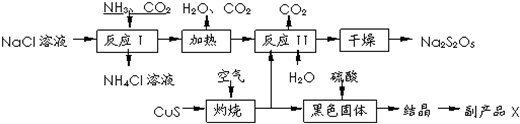
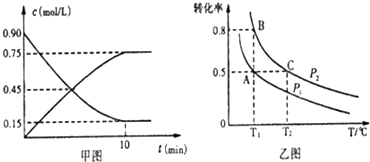 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.
