题目内容
铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示.
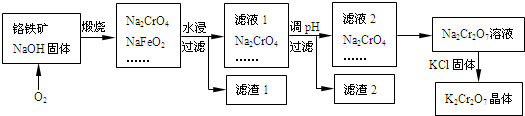
已知:①NaFeO2遇水强烈水解.
②Cr2O72-+H2O═2CrO42-+2H+
请回答:
(1)生成滤渣1中红褐色物质的反应的化学方程式是 .滤液1的成分除Na2CrO4外,还含有(填化学式) .
(2)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 .
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是 .
(4)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、洗涤、干燥.
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 .

已知:①NaFeO2遇水强烈水解.
②Cr2O72-+H2O═2CrO42-+2H+
请回答:
(1)生成滤渣1中红褐色物质的反应的化学方程式是
(2)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是
(4)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、洗涤、干燥.
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题,元素及其化合物
分析:铬铁矿通过焙烧,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解得固体氢氧化铁和溶液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,硅酸盐完全沉淀;继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)依据流程图和题干反应分析判断发生的反应及滤液1的成分;
(2)滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2,经调节pH可获得氢氧化铝和硅酸沉淀,加热两种沉淀得到氧化铝和二氧化硅,电解氧化铝得到金属铝;
(3)铬酸根在酸性条件下可以转化为重铬酸根;
(4)溶液中得到溶质晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥步骤分析回答;
(5)根据流程,反应物为FeO?Cr2O3、NaOH和7O2,生成物为Na2CrO4、NaFeO2和H20,配平即可.
(1)依据流程图和题干反应分析判断发生的反应及滤液1的成分;
(2)滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2,经调节pH可获得氢氧化铝和硅酸沉淀,加热两种沉淀得到氧化铝和二氧化硅,电解氧化铝得到金属铝;
(3)铬酸根在酸性条件下可以转化为重铬酸根;
(4)溶液中得到溶质晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥步骤分析回答;
(5)根据流程,反应物为FeO?Cr2O3、NaOH和7O2,生成物为Na2CrO4、NaFeO2和H20,配平即可.
解答:
解:(1)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,加入氧气和氢氧化钠,发生反应为:
①4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O;
②2NaOH+Al2O3
2NaAlO2+H20;
③2NaOH+SiO2
Na2SiO3+H20;
水浸发生NaFeO2的水解:NaFeO2+2H2O=NaOH+Fe(OH)3↓,
操作Ⅰ是过滤,得到滤渣1为Fe(OH)3;滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2;
故答案为:NaFeO2+2H2O=NaOH+Fe(OH)3↓;NaAlO2、Na2SiO3(NaOH写或没写均不扣分);
(2)滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2,经调节pH可获得氢氧化铝和硅酸沉淀,加热两种沉淀得到氧化铝和二氧化硅,电解氧化铝得到金属铝,反应方程式为:2Al2O3(熔融)
4Al+3O2↑;故答案为:2Al2O3(熔融)
4Al+3O2↑;
(3)根据题目信息:Cr2O72-+H2O?2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:加硫酸酸化;
(4)获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶,过滤;
(5)根据流程,反应物为FeO?Cr2O3、NaOH和7O2,生成物为Na2CrO4、NaFeO2和H20,反应方程式为:4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O;
故答案为:4FeO?Cr2O3+7O2+20NaOH
8Na2CrO4+4NaFeO2+10H2O.
①4FeO?Cr2O3+7O2+20NaOH
| ||
②2NaOH+Al2O3
| ||
③2NaOH+SiO2
| ||
水浸发生NaFeO2的水解:NaFeO2+2H2O=NaOH+Fe(OH)3↓,
操作Ⅰ是过滤,得到滤渣1为Fe(OH)3;滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2;
故答案为:NaFeO2+2H2O=NaOH+Fe(OH)3↓;NaAlO2、Na2SiO3(NaOH写或没写均不扣分);
(2)滤液1中含Na2CrO4、Na2SiO3、NaOH和NaAlO2,经调节pH可获得氢氧化铝和硅酸沉淀,加热两种沉淀得到氧化铝和二氧化硅,电解氧化铝得到金属铝,反应方程式为:2Al2O3(熔融)
| ||
| ||
(3)根据题目信息:Cr2O72-+H2O?2CrO42-+2H+,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,故答案为:加硫酸酸化;
(4)获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶,过滤;
(5)根据流程,反应物为FeO?Cr2O3、NaOH和7O2,生成物为Na2CrO4、NaFeO2和H20,反应方程式为:4FeO?Cr2O3+7O2+20NaOH
| ||
故答案为:4FeO?Cr2O3+7O2+20NaOH
| ||
点评:本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度较大.

练习册系列答案
相关题目
将4.28gNa、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到672mL混合气体,该混合气体在放电条件下恰好完全反应,则原混合物中各物质的物质的量之比为( )
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
下列叙述正确的是( )
| A、NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO3- |
| B、CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 |
| C、等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |