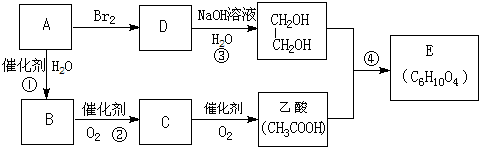
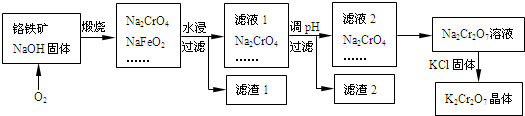
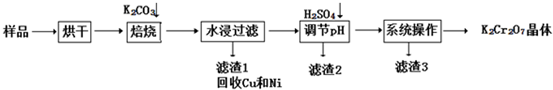
题目内容
现有一包铝热剂是铝粉和氧化铁粉末的混合物,均分为两等份,进行如下反应:
(1)向其中一份固体中加入100mL 3.0mol?L-1的NaOH溶液,使其充分反应,反应后测得溶液的c(OH-)=1.0mol?L-1(假定反应前后溶液的体积不变),求产生气体的体积为多少升?(标准情况)
(2)另一份在高温下使之充分反应,且反应物恰好完全反应,求转移的电子数目为多少?
(1)向其中一份固体中加入100mL 3.0mol?L-1的NaOH溶液,使其充分反应,反应后测得溶液的c(OH-)=1.0mol?L-1(假定反应前后溶液的体积不变),求产生气体的体积为多少升?(标准情况)
(2)另一份在高温下使之充分反应,且反应物恰好完全反应,求转移的电子数目为多少?
考点:化学方程式的有关计算
专题:
分析:(1)Al和Fe2O3的混合物只有Al和NaOH溶液反应,充分反应后溶液中(OH-)=1.0mol?L-1,说明Al完全反应,NaOH有剩余,则参加反应的n(NaOH)=3.0mol/L×0.1L-1.0mol/L×0.1L=0.2mol,根据转移电子相等计算生成氢气体积;
(2)根据Al和NaOH之间的关系式计算Al的物质的量,Al和Fe2O3高温下发生铝热反应生成Fe和Al2O3,根据Al和转移电子之间的关系式计算转移电子数.
(2)根据Al和NaOH之间的关系式计算Al的物质的量,Al和Fe2O3高温下发生铝热反应生成Fe和Al2O3,根据Al和转移电子之间的关系式计算转移电子数.
解答:
解:(1)Al和Fe2O3的混合物只有Al和NaOH溶液反应,充分反应后溶液中(OH-)=1.0mol?L-1,说明Al完全反应,NaOH有剩余,则参加反应的n(NaOH)=3.0mol/L×0.1L-1.0mol/L×0.1L=0.2mol,设生成氢气体积为x,
2NaOH+2H2O+2Al=2NaAlO2+3O2↑
2mol 67.2L
0.2mol x
2mol:67.2L=0.2mol:x
x=
=6.72L,
答:产生气体的体积为6.72L;
(2)设和NaOH反应的Al的物质的量为y,
2NaOH+2H2O+2Al=2NaAlO2+3O2↑
2mol 2mol
0.2mol y
2mol:2mol=0.2mol:y
y=
=0.2mol
设转移电子物质的量为z,
2Al+Fe2O3
2Fe+Al2O3 转移电子
2mol 6NA
0.2mol z
2mol:6NA=0.2mol:z
z=
=0.6NA
答:转移的电子数目为0.6NA.
2NaOH+2H2O+2Al=2NaAlO2+3O2↑
2mol 67.2L
0.2mol x
2mol:67.2L=0.2mol:x
x=
| 67.2L×0.2mol |
| 2mol |
答:产生气体的体积为6.72L;
(2)设和NaOH反应的Al的物质的量为y,
2NaOH+2H2O+2Al=2NaAlO2+3O2↑
2mol 2mol
0.2mol y
2mol:2mol=0.2mol:y
y=
| 2mol×0.2mol |
| 2mol |
设转移电子物质的量为z,
2Al+Fe2O3
| ||
2mol 6NA
0.2mol z
2mol:6NA=0.2mol:z
z=
| 0.2mol×6NA |
| 2mol |
答:转移的电子数目为0.6NA.
点评:本题考查根据方程式的计算,明确物质之间的反应是解本题关键,侧重考查分析问题、计算能力,首先要进行过量计算,依据量少的物质为标准进行计算,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
等质量的O3和O2相同的是( )
| A、原子数 | B、分子数 |
| C、体积 | D、物质的量 |
当合成氨反应进行到下列状态时,反应已处于平衡状态的是( )
| A、NA个N≡N键形成的同时,有NA个H-H键形成 |
| B、NA个N≡N键断裂的同时,有3NA个H-H键断裂 |
| C、NA个N≡N键断裂的同时,有6NA个N-H键断裂 |
| D、NA个N≡N键断裂的同时,有2NA 个N-H键形成 |