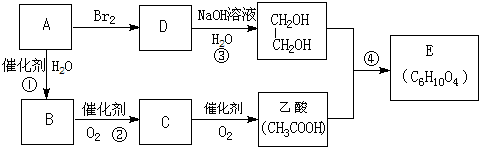
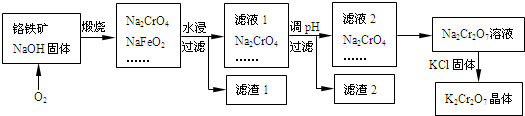
题目内容
将4.28gNa、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到672mL混合气体,该混合气体在放电条件下恰好完全反应,则原混合物中各物质的物质的量之比为( )
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
考点:有关混合物反应的计算
专题:
分析:Na、Na2O、Na2O2 的混合物与足量的水,反应得到的气体是氢气和氧气的混合物,有关方程式为:2Na+2H2O=2NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,将该混合气体通过放电,发生反应:2H2+O2
2H2O,气体恰好完全反应,说明氢气与氧气物质的量之比为2:1,
对于选择题,结合方程式可以确定钠与过氧化钠的物质的量之比,与氧化钠的物质的量无关,结合选项进行排除;
对于非选择题,计算混合气体总物质的量,进而计算氢气、氧气物质的量,根据方程式计算Na、过氧化钠的物质的量,根据m=nM计算钠、过氧化钠的质量,进而计算氧化钠的质量,再根据n=
计算氧化钠的物质的量,据此计算三者物质的量之比.
| ||
对于选择题,结合方程式可以确定钠与过氧化钠的物质的量之比,与氧化钠的物质的量无关,结合选项进行排除;
对于非选择题,计算混合气体总物质的量,进而计算氢气、氧气物质的量,根据方程式计算Na、过氧化钠的物质的量,根据m=nM计算钠、过氧化钠的质量,进而计算氧化钠的质量,再根据n=
| m |
| M |
解答:
解:Na、Na2O、Na2O2 的混合物与足量的水,反应得到的气体是氢气和氧气的混合物,有关方程式为:2Na+2H2O=2NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,将该混合气体通过放电,发生反应:2H2+O2
2H2O,气体恰好完全反应,说明氢气与氧气物质的量之比为2:1,
假设氢气为2mol,则氧气为1mol,由方程式2Na+2H2O=2NaOH+H2↑,可知Na为2mol×2=4mol,由2Na2O2+2H2O=4NaOH+O2↑,可知过氧化钠为2mol,故混合物中Na与过氧化钠物质的量之比为4:2=2:1,选项中只有D符合,故选D.
| ||
假设氢气为2mol,则氧气为1mol,由方程式2Na+2H2O=2NaOH+H2↑,可知Na为2mol×2=4mol,由2Na2O2+2H2O=4NaOH+O2↑,可知过氧化钠为2mol,故混合物中Na与过氧化钠物质的量之比为4:2=2:1,选项中只有D符合,故选D.
点评:本题考查混合物计算、化学方程式计算,难度中等,关键在于根据氢气与氧气恰好完全反应确定二者比例关系,再根据方程式比例关系解答,注意利用排除法解答,若采用常规做法,计算量较大,较容易出错.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L H2O所含分子数为0.5NA |
| B、标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA |
| C、1mol?L-1 CaCl2溶液中所含Ca2+离子的数目为NA |
| D、通常状况下,32g O2 和O3 的混合物所含的氧原子数一定为2NA |
下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A、生石灰、白磷、冰水混合物 |
| B、烧碱、液氧、碘酒 |
| C、干冰、铁、氯化氢 |
| D、纯碱、氮气、胆矾 |