题目内容
计算25℃时下列溶液的PH值:
(1)1mlPH=2的H2SO4加水稀释至100ml,PH= ;
(2)0.001mol/L的盐酸,PH= ;
(3)0.01mol/L的NaOH溶液,PH= ;
(4)0.015mol/L的H2SO4与0.01mol/L的NaOH等体积混合,混合液的PH= .
(1)1mlPH=2的H2SO4加水稀释至100ml,PH=
(2)0.001mol/L的盐酸,PH=
(3)0.01mol/L的NaOH溶液,PH=
(4)0.015mol/L的H2SO4与0.01mol/L的NaOH等体积混合,混合液的PH=
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)1mL pH=2的H2SO4溶液加水稀释到100mL,c(H+)由0.01mol/L变为0.0001mol/L;
(2)根据盐酸为一元强酸计算氢离子浓度,再根据pH=-lgc(H+)计算;
(3)0.01mol/L的NaOH溶液中氢氧根离子浓度为0.01mol/L,根据c(H+)=
计算出氢离子浓度,再计算出溶液的pH;
(4)设溶液体积为1L,计算出硫酸中氢离子、氢氧化钠溶液中氢氧根离子的物质的量,然后判断过量,计算出混合液中氢离子浓度,最后根据pH=-c(H+)计算出溶液的pH.
(2)根据盐酸为一元强酸计算氢离子浓度,再根据pH=-lgc(H+)计算;
(3)0.01mol/L的NaOH溶液中氢氧根离子浓度为0.01mol/L,根据c(H+)=
| 1×10-14 |
| C(OH-) |
(4)设溶液体积为1L,计算出硫酸中氢离子、氢氧化钠溶液中氢氧根离子的物质的量,然后判断过量,计算出混合液中氢离子浓度,最后根据pH=-c(H+)计算出溶液的pH.
解答:
解:25℃时:Kw=c(OH-)×c(H+)=10-14,根据pH=-c(H+)计算;
(1)1mL pH=2的H2SO4溶液加水稀释到100mL,溶液中氢离子浓度c(H+)由0.01mol/L变为0.0001mol/L,则稀释后溶液的pH=-lg0.0001=4,
答:常温下,1mLpH=2的H2SO4加水稀释至100mL,稀释后溶液的pH为4;
(2)盐酸为一元强酸完全电离,0.001mol/L的盐酸氢离子浓度c(H+)=0.001mol/L,pH=-lgc(H+)=-lg0.001=3,
答:0.001mol/L的盐酸PH为3;
(3)NaOH为强电解质,则0.01mol/L的NaOH溶液中c(OH-)=0.01mol/L,c(H+)=
mol/L=
mol/L=1×10-12mol/L,该氢氧化钠溶液的pH=-lg1×10-12=12,
答:常温下0.01mol/L的NaOH溶液的pH=12;
(4)设两溶液的体积为1L,1L 0.015mol/L的硫酸中氢离子的物质的量为:n(H+)=0.015mol/L×2×1L=0.03mol,
1L 0.01mol/L的NaOH溶液中含有氢氧根离子的物质的量为:n(OH-)=0.01mol/L×1L=0.01mol,
硫酸过量,混合液中氢离子浓度为:c(H+)=
=0.01mol/L,
混合液的pH=-lg0.01=2,
答:混合溶液的pH=2.
(1)1mL pH=2的H2SO4溶液加水稀释到100mL,溶液中氢离子浓度c(H+)由0.01mol/L变为0.0001mol/L,则稀释后溶液的pH=-lg0.0001=4,
答:常温下,1mLpH=2的H2SO4加水稀释至100mL,稀释后溶液的pH为4;
(2)盐酸为一元强酸完全电离,0.001mol/L的盐酸氢离子浓度c(H+)=0.001mol/L,pH=-lgc(H+)=-lg0.001=3,
答:0.001mol/L的盐酸PH为3;
(3)NaOH为强电解质,则0.01mol/L的NaOH溶液中c(OH-)=0.01mol/L,c(H+)=
| 1×10-14 |
| C(OH-) |
| 1×10-14 |
| 0.01 |
答:常温下0.01mol/L的NaOH溶液的pH=12;
(4)设两溶液的体积为1L,1L 0.015mol/L的硫酸中氢离子的物质的量为:n(H+)=0.015mol/L×2×1L=0.03mol,
1L 0.01mol/L的NaOH溶液中含有氢氧根离子的物质的量为:n(OH-)=0.01mol/L×1L=0.01mol,
硫酸过量,混合液中氢离子浓度为:c(H+)=
| 0.03mol-0.01mol |
| 2L |
混合液的pH=-lg0.01=2,
答:混合溶液的pH=2.
点评:本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确酸与酸、碱与碱、酸与碱的混合液的pH的计算方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验方案正确且能达到相应实验预期目的是( )
A、 制取少量蒸馏水 |
B、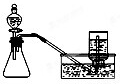 用铜和浓硝酸混合制取少量NO2 |
C、 比较MnO2、Cl2、I2的氧化性 |
D、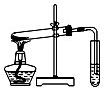 探究NaHCO3的热稳定性 |
下列有关环境保护的说法中正确的是( )
| A、含氮、磷化合物的生活污水大量排放可使水体富营养化,造成潮汐 |
| B、各国工业大量排放二氧化硫是全球气候变暖的主要原因 |
| C、劣质装修材料中的甲醛、苯、氡气等对人体有害 |
| D、废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染 |
对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ?mol-1最准确的理解是( )
| A、碳和水反应吸收131.3 kJ热量 |
| B、1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量 |
| C、1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量 |
| D、1个固态碳原子和1分子水蒸气反应吸热131.1 kJ |
下列各组物质属于同分异构体的是( )
A、 和 和 |
| B、O2和O3 |
| C、CH3CH2OH和CH3OCH3 |
| D、12C和13C |

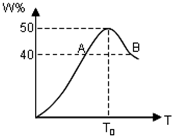 2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线: